 Predicting the risk for lymphoma development in Sjogren syndrome. Medicine (Baltimore). 2016 Jun; 95(25): e3766.
Predicting the risk for lymphoma development in Sjogren syndrome. Medicine (Baltimore). 2016 Jun; 95(25): e3766.
【Introduction】
- Sjogren syndrome (SS)は主に唾液腺や涙腺などの外分泌腺に対しておこる自己免疫疾患であり、結果として口腔内や口腔粘膜の組織の乾燥がおこる CMAJ 2014; 186:E579–E586.
-
Sjögren症候群(SS)患者の一部では、全身症状が生じることがあり、B-cell non-Hodgkin lymphoma (NHL)B細胞性非ホジキンリンパ腫は約5%の患者が罹患する重篤な合併症である Arthritis Rheum 1999; 42:1765–1772.
-
SSでのNHL発生のリスクは、全身性自己免疫疾患の中で最も高く、一般集団と比較して7~19倍高いと以前から推定されている Arthritis Care Res 2013; 65:816–821.
-
唾液腺を中心とする粘膜関連リンパ組織(MALT)は、原発性SS患者の間で1000倍のリスクを持つ顕著な組織学的リンパ腫タイプであるが、びまん性大細胞型B細胞性リンパ腫などのよりアグレッシブな亜型も起こりうる J Int Cancer 2009; 125:398–405.
-
自己免疫、特にSSにおけるリンパ腫の発生機序は多因子プロセスによるものと考えられており、まだ完全には解明されていないが、以下が関与していると考えられている
-
染色体転座 J Exp Med 1991; 174:1245–1250
-
腫瘍抑制遺伝子p53の変異 Arthritis Rheum 1999; 42:1466–1472.
-
自然免疫および適応免疫活性化経路の両方で制御的役割を果たす分子の多型などの遺伝子異常 Blood 2013; 122:4068–4076.
-
-
さらに先行研究によると、以下の要素もSS関連NHL発症の有害予測因子として特定されている
-
持続的なsalivary gland enlargement(SGE)唾液腺腫大 Arthritis Rheum 2002; 46:741–747.
-
触知可能な紫斑
-
リンパ球減少やモノクローナルII型クリオグロブリン血症 Semin Arthritis Rheum 2000; 29:296–304.
-
低補体血症 Medicine (Baltimore) 2009; 88:284–293.
-
minor salivary gland(MSG)小唾液腺の生検における強いリンパ球浸潤 Ann Rheum Dis 2014; 73:1537–1540.
-
胚中心形成 Ann Rheum Dis 2011; 70:1363–1368.
-
本研究の目的
-
診断時に早期に観察される臨床的、血液学的、血清学的、病理組織学的特徴に基づいて、SS関連NHL発症の臨床における予測ツールを作成すること
【Methods】
Study cohort
-
the revised European/American International classification criteria for SSを満たす NHL合併のSS患者92名(concomitant NHL :SS NHL)と合併していない381の原発性SS患者(SS)をレトロスペクティブコホート
-
他の全身性自己免疫疾患に続発するSS患者は除外した
-
全患者群の83.7%がMSG生検を受けた(63.9%がMSG陽性、focus score≧1と定義)
-
全患者群の92.6%が抗Ro/SSA and/or 抗La/SSBの検査を受けており、74.4%は抗Ro/SSA and/or 抗La/SSB陽性であった
-
SS NHL 92例中、73例がMALTリンパ腫、19例が非MALTリンパ腫(以下に内訳を記載)であった
-
diffuse large B-cell lymphomaびまん性大細胞型B細胞リンパ腫12例(うち2例はMALTリンパ腫の転移由来)
-
nodal marginal zone lymphoma結節性辺縁帯リンパ腫4例
-
small lymphocytic lymphoma小リンパ球性リンパ腫2例
-
T-cell lymphomaT細胞性リンパ腫1例
-
-
Demographic, clinical, and laboratory evaluation
-
SS診断時の人口統計学的、臨床的、および臨床検査データは、広範囲に臨床カルテレビューを通じて収集された
-
口腔、眼、皮膚、上気道の乾燥、SGE、ならびに眼(abnormal Schirmer test ≦ 5mm/5分、ocular dye score ≧ 4)および口腔(unstimulated salivary flow 無刺激唾液量 ≦ 1.5mL/15分)などの腺症状の存在に関する情報
-
筋痛、関節痛、関節炎などの筋骨格系の不快感、レイノー現象、触知可能な紫斑、電気生理学的研究に基づく末梢神経系(PNS)の病変、リンパ節腫脹、脾腫、組織学的に証明された間質性腎疾患、糸球体腎炎、自己免疫肝炎、原発胆汁性肝硬変などの全身的特徴
-
SS NHL患者群におけるリンパ腫のhistological subtype組織学的サブタイプ
-
白血球数、血小板数、ヘモグロブリン値などの血液学的特徴
-
高ガンマグロブリン血症、モノクローナルガンマ症、自己抗体(抗核抗体、抗Ro/SSA、抗La/SSB抗体、リウマトイド因子[RF]、抗ミトコンドリア、抗甲状腺)、クリオグロブリンおよびC3、C4補体タンパク値などの血清学的特徴
-
以下にそれぞれの定義を示す
-
Leukopenia: white blood cells number <4000/μL,
-
lymphocytopenia: lymphocytes number <1000/μL,
-
thrombocytopenia: platelets number <250,000/μL,
-
anemia: hemoglobulin levels <12 g/dL,
-
C3 and C4 hypocomplementemia: levels <90 and 20 mg/dL, respectively,
-
RF positivity: levels >20 IU/mL.
-
-
MSG組織のレベルではTarpleyおよびfocusスコアを用いて評価した以下の情報も記録(Tarpleyスコアやfocusスコアなどの連続変数については、その中央値をカットオフ値として選択)
-
リンパ球浸潤の程度 Ann Rheum Dis 2002; 61:554–558.
-
胚中心形成
-
単クローン性の有無 Clin Exp Immunol 2010; 161:57–64.
-
-
Statistical analysis
-
解析はGraph Pad Prism 5.00とSPSS software 21.0を使用
-
Fisher exact/Chi-square testとMann-Whitney U test
-
単変量および多変量ロジスティック回帰モデル
-
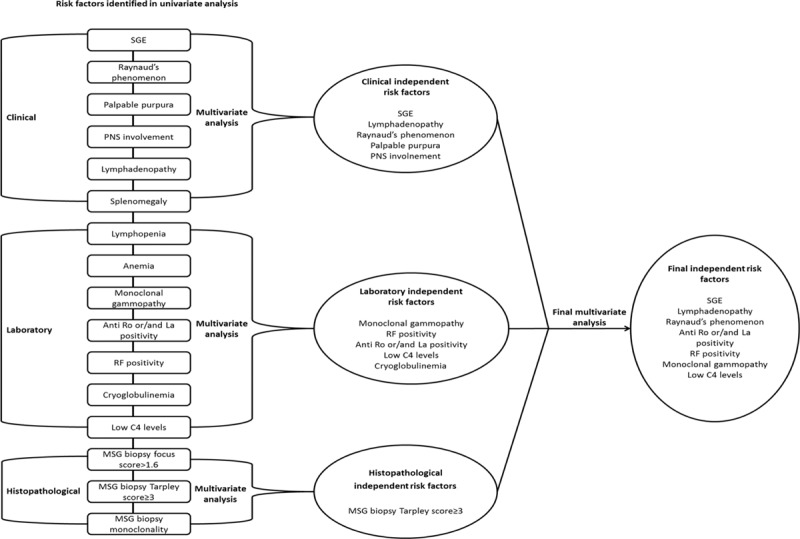
-
リンパ腫発症の予測因子を、臨床的特徴、検査的特徴、病理組織学的特徴を含む3つの主要グループにそれぞれ分類
-
各グループについて、一変量解析で有意とされたパラメータのみを含む3つの独立した多変量解析モデルを構築
-
最後に、3つのモデルで有意であった独立した予測因子を含む最終的な多変量モデルを構築
-
最後のステップで特定された独立した予測因子の最終リストは、下記の式に従ってNHLの相対リスクを計算した
-
Risk = [exp(βl × xli + … + βp × xpi)]/{1 + [exp(βl × xli + … + βp × xpi)]}
-
この式において、β1〜βpは独立した特徴の回帰係数であり、xli〜xpiは特定の患者に対する独立したリスクファクターに対応する値である
-
-
-
予測モデルの全体的な性能を評価するために,較正(Hosmer-Lemeshow 統計)と識別(Receiver Operating Characteristic Statistic)の尺度を計算
-
二項ロジスティック回帰を用いて、SS診断時に存在する危険因子(多変量解析の最終段階で特定)の数に基づくSSN HL発症の予後確率を算出
【Results】
Demographic data

-
SSおよびSS NHL群において
-
診断時平均年齢はそれぞれ51.6±13.2歳と50.3±13.4歳
-
女性:男性比はそれぞれ17:1と14:1
-
-
SS NHL群のうち、SS MALT群と非MALT群において
-
年齢は、それぞれ49.9±12.7と52.1±16.2であり、群間の有意差は検出されなかった
-
SS群とSS NHL群における臨床的、血液学的、血清学的、病理組織学的特徴
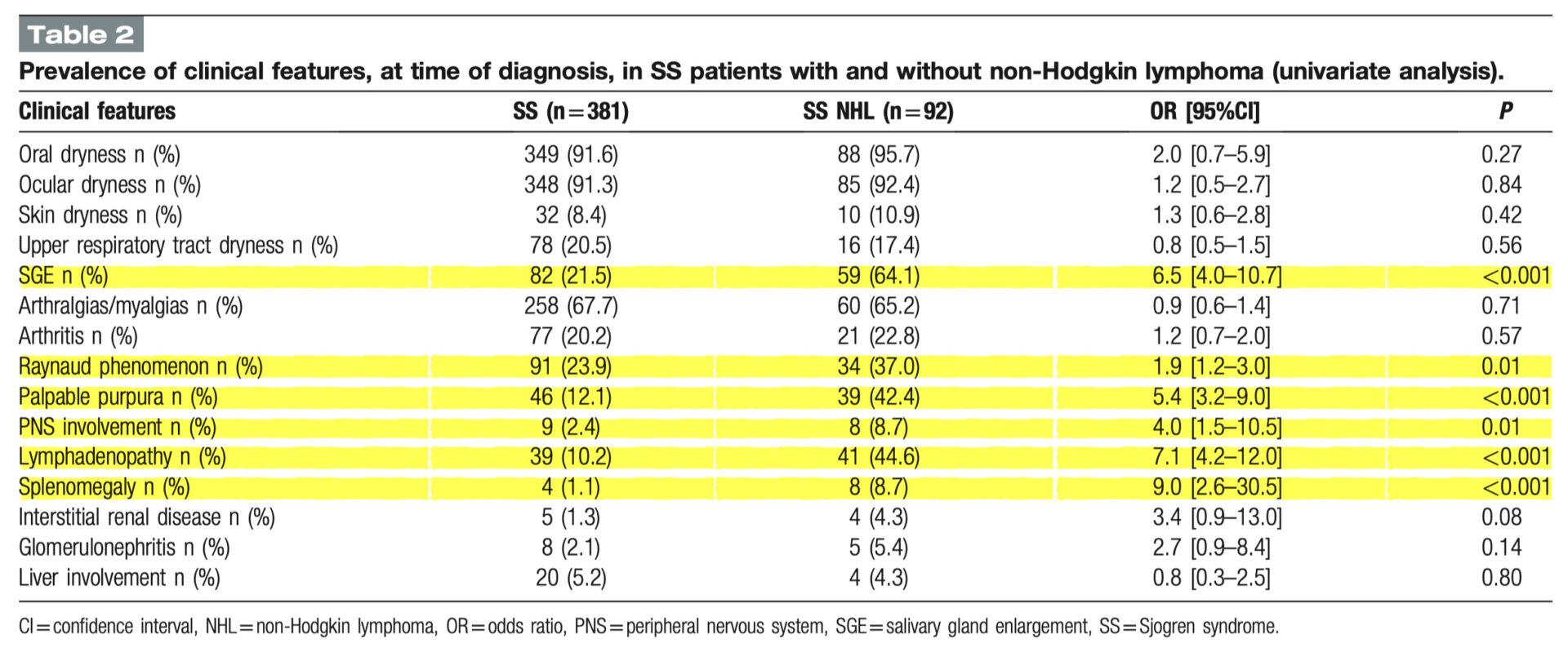
単変量解析にて、NHLを発症したSS患者と発症していないSS患者における発症時の臨床症状および検査値の有病率を以下に示す
-
外分泌機能障害(口腔、眼球、皮膚、上気道の乾燥)、関節炎を含む筋骨格系の不快感、腎臓および肝臓の病変に関しては、2つのグループで同程度の割合であった
-
SS NHL 患者は SS グループと比較して有意差があるものは以下のものである
-
レイノー現象 (37.0% vs 23.9%, P = 0.01)
-
SGE (64.1% vs 21.5%, P < 0. 001)
-
触知可能な紫斑(42.4% vs 12.1%, P < 0.001)、
-
リンパ節腫脹(44.6% vs 10.2%, P < 0.001)
-
脾臓腫大(8.7% vs 1.1%, P < 0.001 )
-
PNS病変(8.7% vs 2.4%, P = 0.01)
-
非ホジキンリンパ腫のあるSS患者群とないSS患者群との診断時の血液学的、血清学的、病理組織学的特徴の比較(単変量解析)
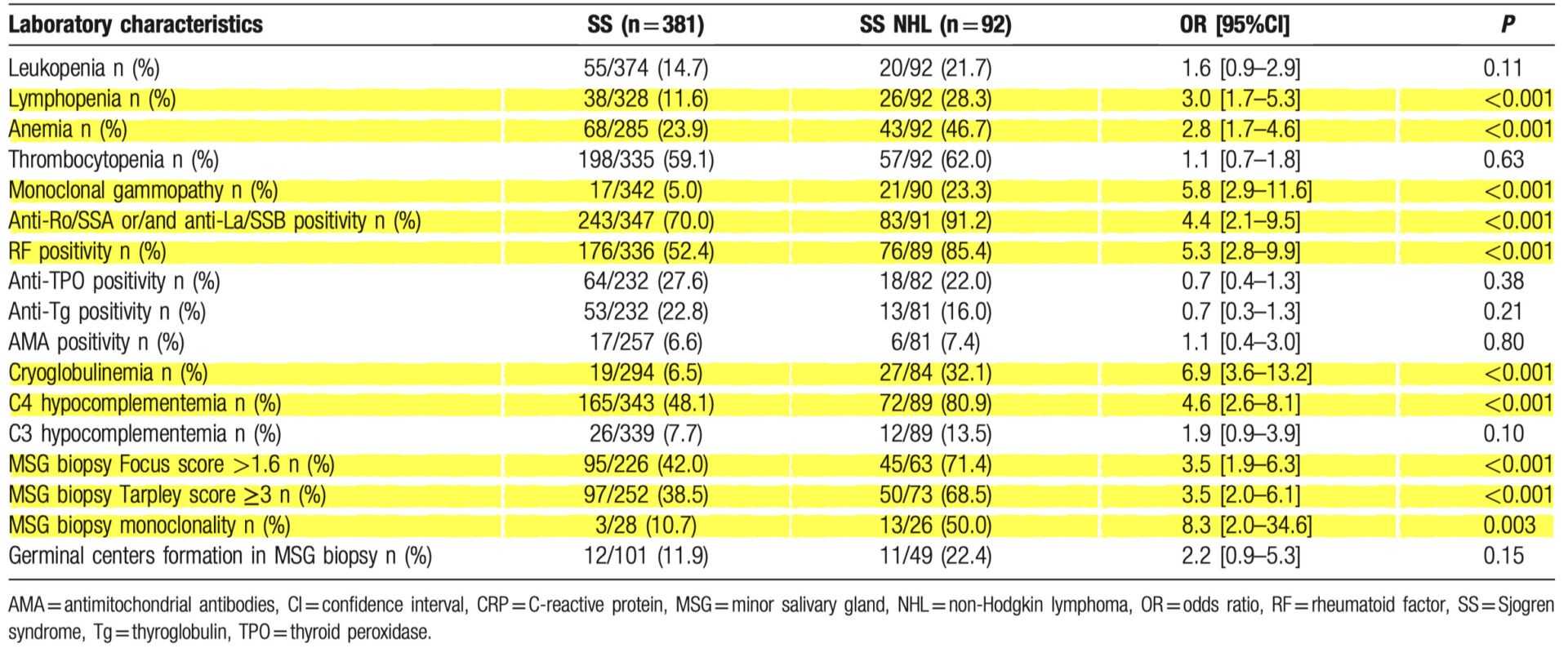
SS NHLの発生は、リンパ球減少(28.3% vs 11.6%、P < 0.001)、貧血(46.7% vs 23.9%、P < 0.001)、RF陽性(85.4% vs 52.4%、P < 0.001)、抗Ro/SSAまたは/および抗La/SSB陽性(91. 2% vs 70.0%、P < 0.001)、単クローン性ガンマグロブリン血症(23.3% vs 5.0%、P < 0.001)、および低C4補体レベル(80.9% vs 48.1%、P < 0.001)で有意に増加することが判明した
-
診断用唾液腺生検の病理組織学的特徴に関して以下の項目は、SS NHL では SS グループと比べす頻繁に起こりやすい結果となった
-
MSG focus score 1.6 以上 (71.4% vs 42.0%, P < 0.001)
-
Tarpley score ≥3 (68.5% vs 38.5%, P < 0.001)
-
MSG 組織における単クローン性の存在 (50.0% vs 10.7%, P = 0.003)
-
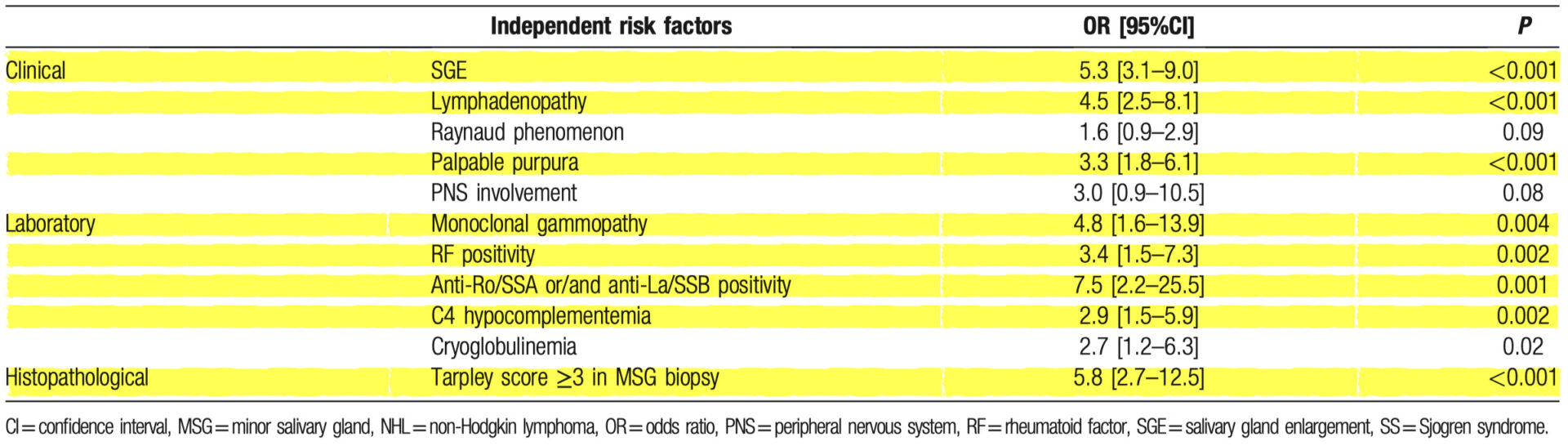
非ホジキンリンパ腫発症の独立した危険因子
下図は臨床的、血清学的、および病理組織学的パラメータに関する3つの個別の多変量モデルの結果を示している。
-
NHLと独立に関連する臨床変数には、SGE、リンパ節腫脹、触知可能な紫斑、PNS病変、およびレイノー現象が含まれていた
-
NHL発症を独立して予測する血清学的および病理組織学的特徴は、RF、抗Ro/SSAまたは/および抗La/SSB陽性、モノクローナルガンマ症、C4低補体症、クリオグロブリン血症、MSG生検におけるTarpleyスコア≥3であった
-
同定された変数が互いに強く関連して多変量モデルの結果をインフレさせているかどうかを検証するために、主成分分析を行った(supplyment data ※ここでは表記しない)
-
このように、3つの独立した多変量モデル(臨床、検査、病理組織学)から得られたすべての独立した予測因子は、SGE、リンパ節腫脹、レイノー現象、抗Ro/SSAまたは/および抗La/SSB陽性、RF陽性、モノクローナルガンマ症、およびC4低補体血症をNHL発症の独立予測因子として最終多変量モデルで同定することが出来た
SS NHL発症の予測スコア
-
ロジスティック回帰分析の結果に基づいて、予測モデルが考案された
-
このモデルでは、以前に説明したように、各患者についてNHL発症の相対リスクが以下の式に従って計算された PloS One 2013; 8:e82992.
-
Risk = EXP[SGE∗(1.456) + Raynaud phenomenon∗(0.831) + lymphadenopathy∗(1.445) + monoclonal gammopathy∗(1.158) + RF positivity∗(1.305) + C4 hypocomplementemia∗(1.088) + anti-Ro/SSA or/and La/SSB positivity∗(1.328)]/{1 + EXP [SGE∗(1.456) + Raynaud phenomenon∗(0.831) + lymphadenopathy∗(1.445) + monoclonal gammopathy∗(1.158) + RF positivity∗(1.305) + C4 hypocomplementemia∗(1.088) + anti-Ro/SSA or/and La/SSB positivity∗(1.328)]}
-
-
-
これらの式において、二値変数は以下のとおり
-
SGE: presence = 1, absence = 0; Raynaud phenomenon: presence = 1, absence = 0; lymphadenopathy: presence = 1, absence = 0; monoclonal gammopathy: presence = 1, absence = 0; RF positivity: presence = 1, absence = 0; C4 hypocomplementemia: presence = 1, absence = 0; and anti-Ro/SSA and/or La/SSB positivity: presence = 1, absence = 0.
-
-
予測モデルのROC曲線を当てはめると、曲線下の面積は0.9、95%CI: 0.8〜0.9、P < 0.001であった
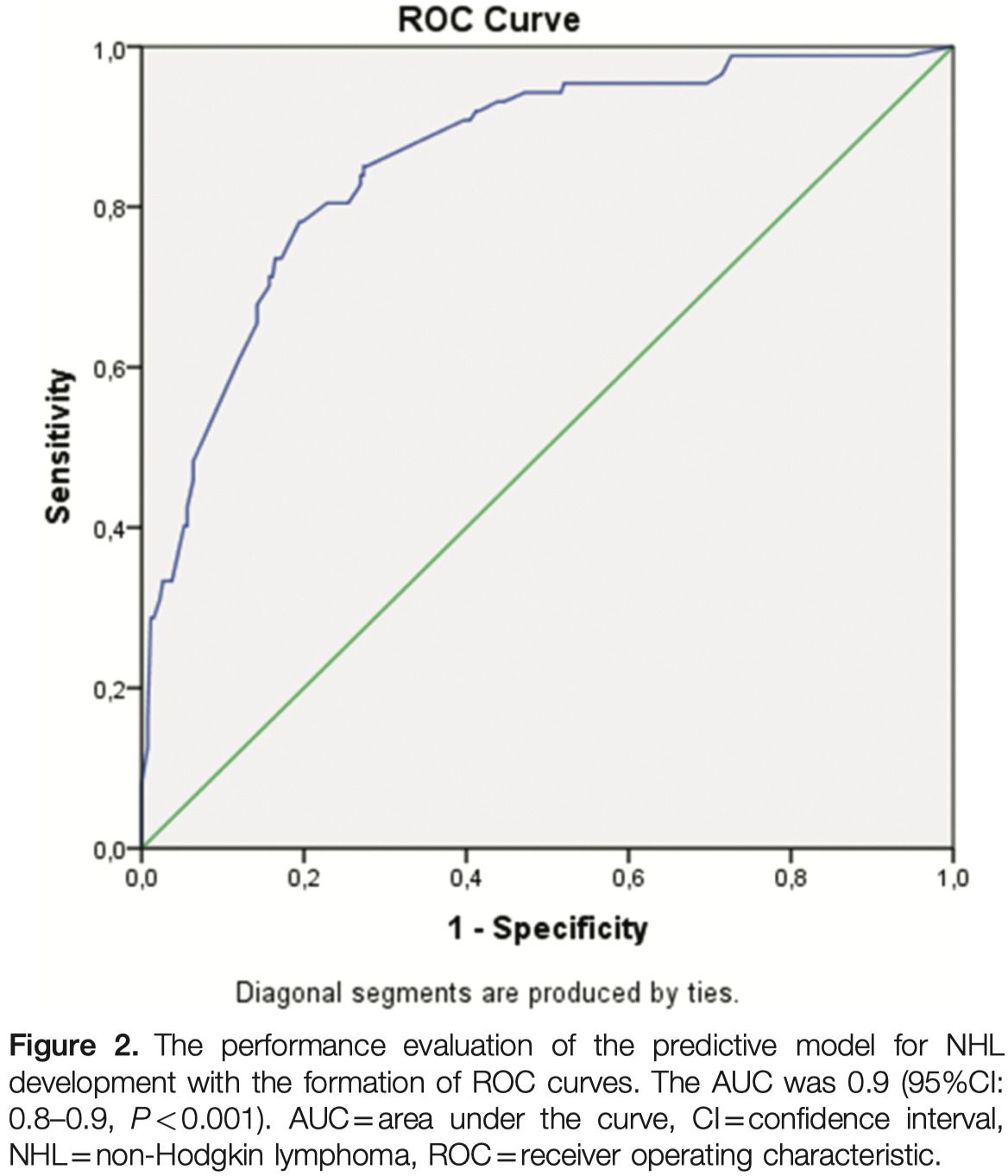
Hosmer-Lemeshow 適合度統計量は 4.8、P = 0.78 であった
-
二項ロジスティック回帰を用いて、NHL発症の予測確率を算出した
-
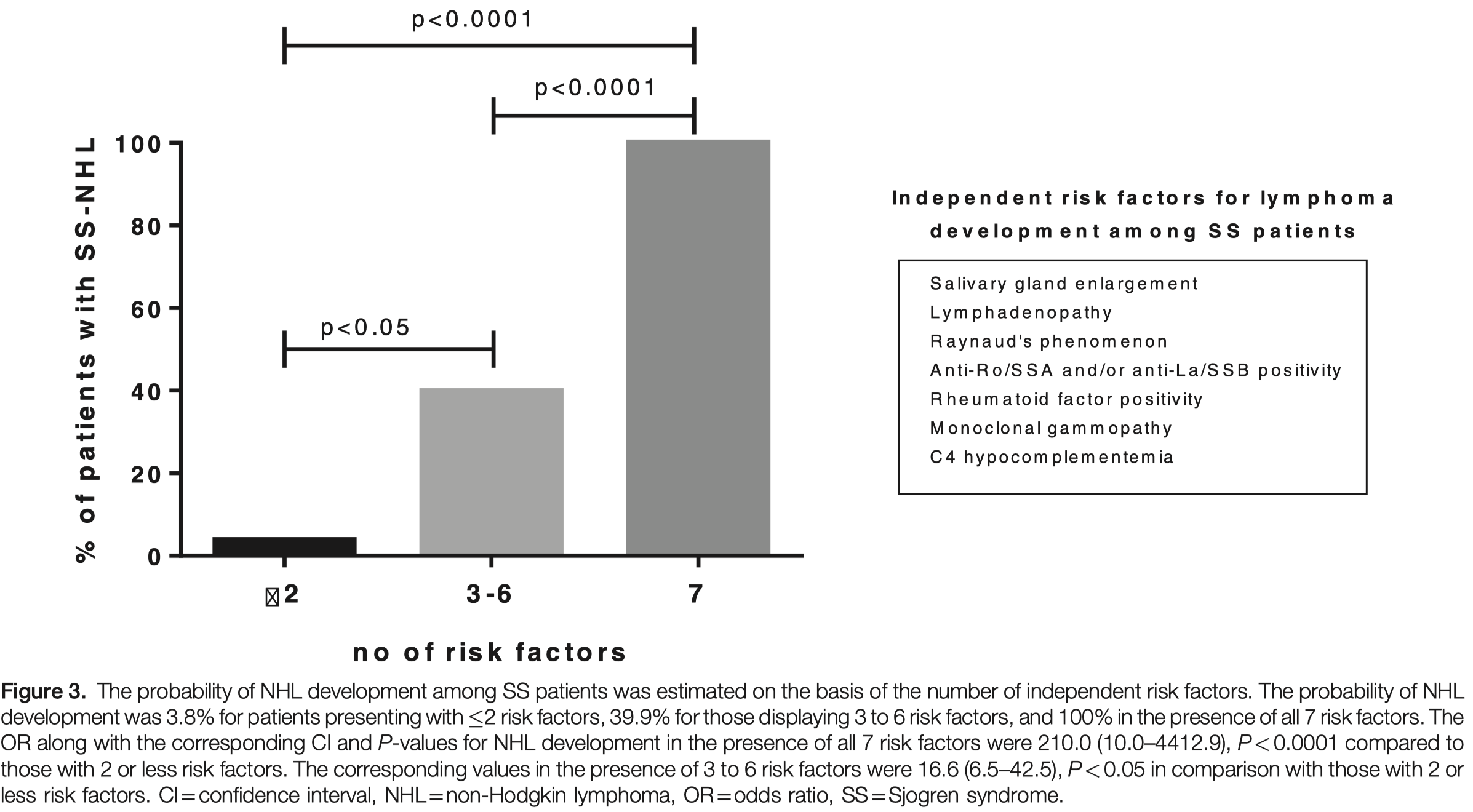
全データが利用可能な患者として、373人中325人(初期コホートの87%)だけを分析した。これら7つの危険因子がない場合、コホート内のSS患者は誰もリンパ腫にならなかった。2以下の患者では、NHL発症の確率は3.8%であった
-
3〜6個の危険因子がある場合のNHL発症確率は39.9%であり、7個すべての危険因子がある場合の確率は100%であった
-
7つの危険因子がすべて存在する場合のNHL発症のORとそれに対応するCIおよびP値は、危険因子が2つ以下の場合と比較して210.0 (10.0-4412.9), P < 0.0001であった
-
3〜6個の危険因子が存在する場合の対応する値は、2個以下の危険因子を示す患者と比較して16.6(6.5-42.5)、P < 0.05であった
-
【Discussion】
-
悪性リンパ腫は、SS患者のかなりの割合で合併症として現れる
-
SSは他の全身性自己免疫疾患患者と比較して最もリスクが高い Arch Intern Med 2005; 165:2337–2344.
-
本研究では、NSS患者の初期の臨床、検査、病理学的評価に基づき、非ホジキンリンパ腫発症の予測モデルを同定した
-
SGE、リンパ節腫脹、触知可能な紫斑、末梢神経障害、レイノー現象などの臨床症状、RF、抗Ro/SSAまたは/および抗La/SSB自己抗体陽性、モノクローナルガンマ症、C4低補体血症、クリオグロブリン血症を含む血清学的特徴、さらにMSG生検における広範囲のリンパ球浸潤 (Tarpley score ≥3) は、HL発症と関連していたことが明らかとなった
-
最終段階の多変量モデルでは、これまでに同定されたすべての予測因子を考慮した結果、SGE、リンパ節腫脹、レイノー現象、抗Ro/SSAまたは/および抗La/SSB、さらにRF陽性、モノクローナルガンマ症、C4低補体血症のみがNHL発症の独立した有害予測因子として決定された
-
独立した危険因子の数に基づいて、NHL発症の予測スコアが考案された
-
NHL発症の確率は、2つ以下の危険因子を持つ患者で3.8%、3から6の危険因子を持つ患者で39.9%、7つすべての危険因子を持つ患者では100%に達していた
-
我々の今回の知見は、いくつかの臨床的および実験的変数がNHL発症の予測因子であることを支持する以前のデータと一致している
-
SGE、リンパ節腫脹などの臨床的特徴、ならびに触知可能な紫斑や末梢神経障害など免疫複合体沈着に関する症状は、重度のSS表現型の決定因子として一貫して特定されてきた
-
-
レイノー現象がNHL発症の独立した有害な予測因子として現れてきたことは、米国の全国調査における以前の観察研究と一致している Arthritis Rheum 2013; 65 suppl 10:221.
-
-
興味深いことに、SS患者のサブセットにおける抗セントロメア抗体の存在は、レイノー現象およびNHLリスクの上昇と以前から関連していた Clin Rheumatol 2010; 29:789–791.
-
残念ながら、この関連性は本研究では調査されなかった
-
というのも、抗セントロメア抗体の自己抗体のデータが限られているためである
-
-
NHL発症に関連する全身症状、またはNHL発症自体と関連する、抗Ro/SSAおよび/または抗La/SSB自己抗体における関連性を明らかにした以前の知見と同様に、これらのリボ核タンパク質複合体に対する抗体はNHL発症の独立した予測因子である、ということも見いだした J Autoimmun 2014; 51:75–80.
-
同じ文脈で、単クローン性免疫グロブリン血症、低補体血症、悪性転化と以前に関連したクリオグロブリン血症も、おそらく過剰なB細胞活性化の結果として、NHL発症および死亡率増加と独立して関連していると示されいる
-
SS関連リンパ腫発生の有害な予後因子として報告されたモノクローナル混合のクリオプレシピテート は、RF活性を示すクローン拡大B細胞に由来する悪性B細胞のサブセットから分泌されるモノクローナルRFを含み、ギリシャとフランスの両方のコホートにおいて、NHLの独立予測因子として現れてきた Arthritis Rheumatol 2016; 68:977–985.
-
著者らはまた、病理組織学的変数に関連して、リンパ球浸潤の密度および単クローン性との間のNHL発症の関連性であったり、胚中心形成に対する正の傾向を観察している
-
多変量解析では、Tarpleyスコア≥3がリンパ腫発生の独立した危険因子であることが明らかになり、以前の観察と一致した Lupus 2015; 24:315–320.
-
単クローン性の存在と胚中心の形成も、以前に提案されたように将来のリンパ腫発生を警告するかもしれないが、おそらく患者数が限られているため、今回の研究では独立予測因子としては特定されていない
-
- 自己抗体の産生、免疫複合体形成に起因する症状、低補体血症につながる古典的構成経路の活性化など、我々のグループや他の研究者によるSSのセッティングでのNHL発症の独立した予測因子は、B細胞の活性化がSS関連リンパ腫発生の主となる病因のメカニズムであることを示している
- これらの有害な予測因子はSSの診断がつくとすぐに現れるということは興味深い
- これは異なる遺伝的背景がSSの低リスクおよび高リスクのサブタイプを決定している可能性を示唆している
- この仮説を支持するものとして、下記の報告がありB細胞活性化に関わる遺伝子変化がSS MALTリンパ腫の原因に関与していることが示唆される Arthritis Rheumatol 2015; 67:2732–2741.
- Bリンパ球の生存因子であるB細胞活性化因子の変異体
- NFKB活性化のゲートキーパーであるTNFα誘導タンパク質3
- NFKBシグナル伝達の交互増強と免疫グロブリン産生を以前に示したB細胞活性化因子受容体のHis159Tyr
- Fms-like tyrosine kinase 3 ligandやケモカインC-X-Cモチーフリガンド13などのBリンパ球の増殖やリンパ組織での組織化に関連する他の分子も、SSのセッティングでのリンパ腫の血清バイオマーカーとして提案されてきた Arthritis Rheum 2010; 62:3447–3456.
- しかし、良性の増殖から悪性転化に至る全メカニズムはまだ解明されていない
Limitation
-
SS-NHLの症例数が比較的少ない
-
ただ一般集団においてSS-NHLが稀であり、また診断が認識されていないことを考えると、現在利用可能な最大のSS-リンパ腫データベースの一つを使用してはいる
-
-
また、患者数が比較的少ないことが、多変量解析モデルにおいて、唾液腺組織レベルの単クローン性をリンパ腫発生の独立した予測因子になりえなかった説明となる可能性かもしれない
-
一方、MALTおよび非MALT NHL症例がグループ全体に集積しているため、別々の病因によって特徴付けられる2つのリンパ腫サブタイプ間の明確な予測因子を同定することができなかった
-
より多くの患者を含むさらなる多施設共同研究により、この問題が明らかになり、現在提案されている予測アルゴリズムが検証される可能性がある
-
-
SS診断時にリンパ腫発症の高リスク表現型を同定することは、長い間、診断上の大きな課題として認識されてきた
-
これまで、個々の臨床パラメーターや検査パラメーターがSSにおけるNHLの予測因子として同定されたていたが、著者らは初めて、独立した有害予測因子の組み合わせに基づいて日常臨床で使いやすいリスク評価ツールを開発し、同時にNHL発症の高リスクSS患者の早期予防治療戦略を設計することができるようになった




