IL-13Rα1-Mediated Signaling Regulates Age-Associated/Autoimmune B-Cell Expansion and Lupus Pathogenesis(2021 ACR1906)
【結論】
- IL-13Rα1欠損はループスマウス自然発症モデルにおけるAge-Autoimmunity-Associated B cells (ABCs)の拡大産生を減少させる
- IL-13Rα1の欠損は、腎炎や肺炎の発症にわずかな影響しか及ぼさない
- 驚くべきことに、IL-13Rα1の欠損は、IL-21刺激にのみ応答してABC形成を減少させる
- IL-13Rα1の欠損は、ABCの転写プロファイルを変化させる
- IL-13Rα1を介したシグナル伝達は、性のバイアスに寄与し、ループス発症を伴う役割がありそう
【背景】
- A systemic autoimmune diseaseは 9:1で女性に多く、出産期に典型的な発症する
- 液性免疫の調節不全とanti-dsDNA, anti-sm/RNP, and anti-phospholipid(anti-cardiolipin, anti-PS) antibodiesの産生が特徴的である
- 腎臓や脳、心臓など様々な臓器に影響を及ぼしうる
- ループスはa highly heterogeneousな疾患である
Age/Autoimmunity-Associated B cells (ABCs)とは/マウスでは加齢に伴い蓄積するユニークな成熟B細胞subset
(マウスでの知見)
- B細胞マーカー と CD11cのようなmyeloid markers骨髄系マーカー の両方を発現している
- ABCsにはT-bet (CD11c+T-bet+)を発現していることが知られている
- ABCのマーカーとしてT-betがよく知られているが、この転写因子に対するABCの依存度は設定によって異なる
- B細胞のT-betはインフルエンザ特異的IgG2c抗体の防御に重要であるが、その欠如はSLEマウスモデルにおけるABCの生成と疾患パラメータに様々な影響を与えている J. Immunol. 205, 1050–1058 (2020).
- plasma cellsに急速に分化し、IgG2a/cを分泌するが、いくつかの炎症性メディエーターであるCCL5を産出することもできる。
- autoimmune miceでは早い段階で増殖していく
- インフルエンザなどに対する抗ウイルス防御に重要な役割を果たしている
(ヒトでの知見)
- DN (IgD -CD27-) or DN2 (IgD-CD27-CXCR5+) B cellsと呼ばれるABC様特徴を持つ細胞が、SLE患者では異常に増殖している。
- 主要な自己抗体の産出源であり、この細胞の蓄と、疾患活動性やループス腎炎とは相関がある。
- ABC様表現型を持つB細胞の増殖は、いくつかの感染症で観察されており、COVID-19患者の疾患重症度と相関している。
- ABCはアフリカ系アメリカ人患者でより多く蓄積し、プラズマブラスト/プラズマ細胞(PB/PC)へと急速に分化し、自己抗体の主要な産生者となり、疾患活動性や臨床症状との相関がある Nat. Immunol. 20, 902–914 (2019).
ABCsの調節
- Toll様受容体:TLR7・TLR9 細胞質内のレセプターが刺激されるとABC増殖
- B細胞受容体:BCR
- T細胞との相互作用 :CD40などで刺激されると活性化する
- サイトカイン
- IFNγ、IL-21 (ABC形成の増加に働く)
- IL-4 (ABC形成の抑制に働く)
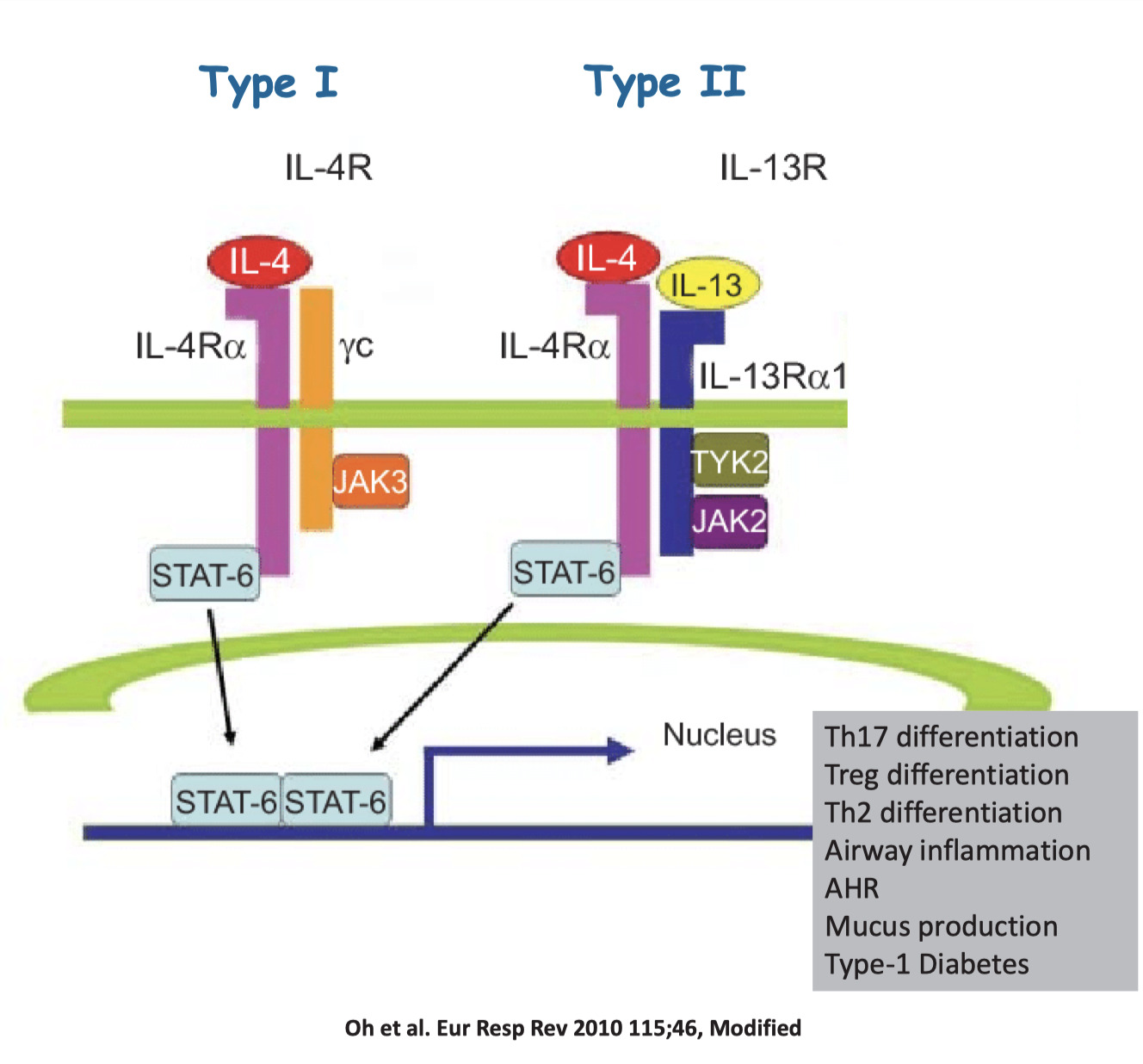
- IL-4のシグナル伝達は、2つの異なるタイプの受容体を介して行われる
- Type I:IL-4Rαおよびγc鎖
- Type II:IL-4RαおよびIL-13Rα1(iL-13Rでもある)
- Type I:IL-4Rαおよびγc鎖
- Type II受容体(IL-4RaおよびIL-13Rα1)は、IL-13に応答するシグナル伝達も媒介する。
IL-13Rα1はX染色体上に存在あする。通常、骨髄系細胞で発現するが、B細胞では発現しない。- 濾胞性B細胞と比較して、ABCsはIL-13Rα1を発現している Manni et al, Nat Immunol, 2018. 19(4): p. 407-419,
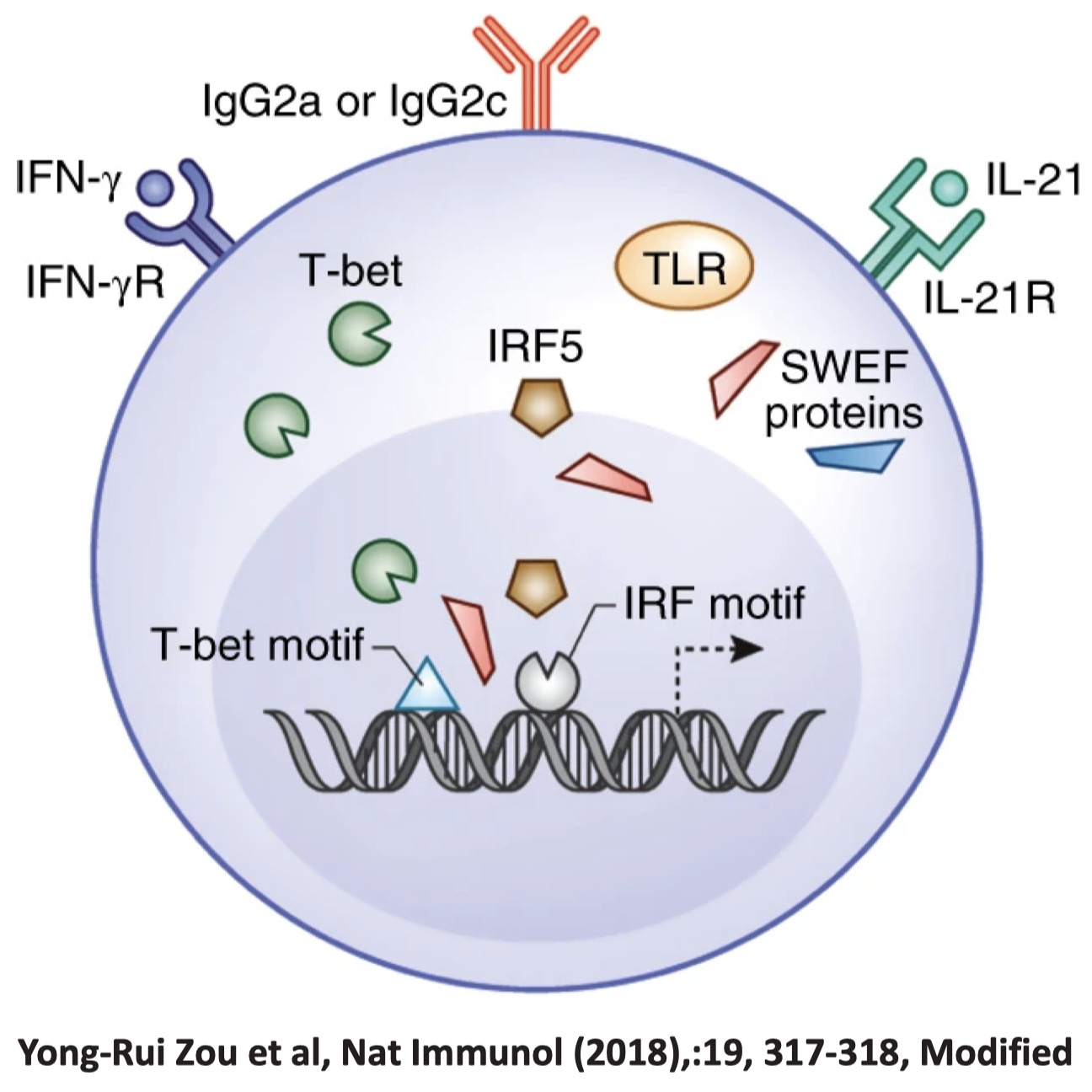
SWEF proteinsについて(細胞質内タンパク質)
- 重要な免疫調節分子で、変異することで、ヒト自己免疫疾患と関連している
- GWAS研究によりDEF6がSLEのリスクバリアントであることが判明している(DEF6の変異があるとSLEのリスクになる)
- SWAP-70は関節リウマチ(RA)のリスクバリアント
- DEF6の変異は、小児の全身性自己免疫の発症を引き起こし、自己抗体生産とIFN signature(によるループスlike様症状)を伴う
- IRF5 (Interferon Regulatory Factor 5) はABCsの制御因子だが、異常を来すと、ABCの蓄積およびSLE発症を促進する。Nat. Immunol. 19, 407–419 (2018).
- IRF5がABCの拡大を促進する能力は、SWEFタンパク質であるDef6とSWAP-70によって抑制することができる。(IRF5とSWEFタンパク質が結合するして核内移行を抑制する。)
- SWEFタンパク質に変異があるとIRF5と結合できない
- IRF5は核内で間接的に阻害するともいわれている
- IRF5がT-bet motifに結合することで、T-betの結合を促進する
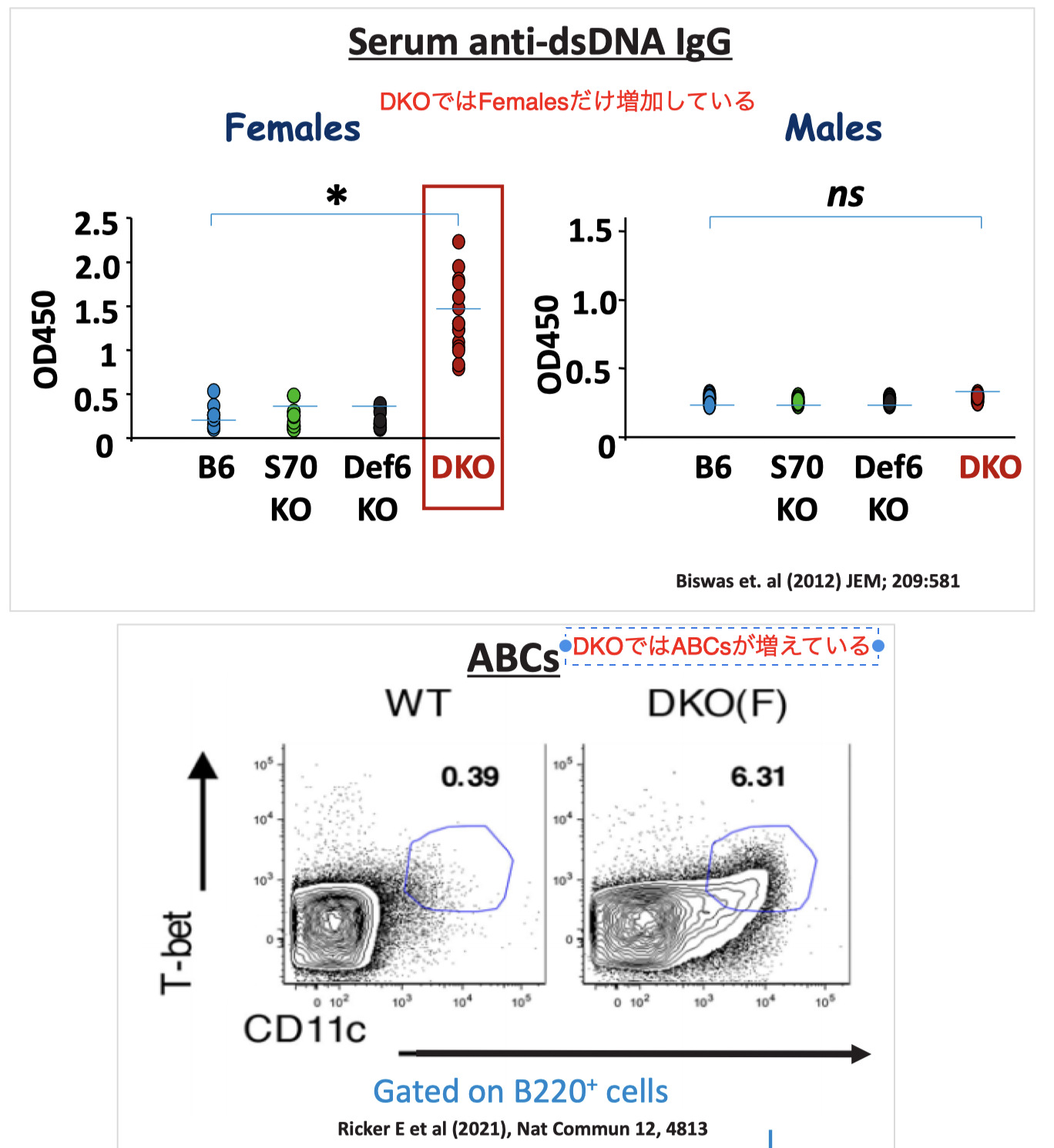
- SWAP-70とDEF6の両方を欠損した雌マウス(DKO=ダブルノックアウト)は、IRF5を抑制できないので、ABC増殖や抗体産生が増長し、C57BL/6バックグラウンドではループス症候群を自然発症する
- IL-21シグナル伝達の異常 でDKOのループスには、ABCの著しい蓄積を伴う。
- DKOにおけるABCの拡大・分化は性特異的に調整されているが(雌でのみ増加する)が、Yaa-DKOの雄のTLR7を刺激することで、同様のことが起こる。(ABCsは内因性のTLR7を刺激しても活性化する)
- DKOマウスでは何らかの刺激で雌マウスだけが、活性化する?
- SLEの病因などのウイルス応答に重要なエンドソームToll様受容体であるTLR7はX染色体上にコードされており、染色体の不活性化を部分的に回避して、女性B細胞、単球、pDCの一部でTLR7の発現量が多くなることがわかっている mmunol. 3, eaap8855 (2018).
(ABCsではIL-13Rα1が発現していて、X染色体上にある)
DKO x IL-13Rα1 欠損マウスを掛け合わせたfemaleマウス(IL-13Rα1-/- DKO)
脾臓はDKOマウスよりも縮小し、ABCsの発現は減少し、また抗体産出も減少する。
Yaa-DKO(TLR7が刺激されている=ABCsのexpansionの方向へ進む)x IL-13Rα1 欠損マウスを掛け合わせたYaa-IL-13Rα1-/- DKO maleマウス
脾臓はYaa-DKOマウスよりも縮小し、ABCsの発現は減少し、また抗体産出も減少する。生存率も上がる。ただし臓器障害に関してはかかわらない。
WT DKO IL-13Rα1-/- DKOのCD23 Bcellsでインターロイキン共培養した結果
- IL-13Rα1がIL-21単独に応答してin vitroでABC形成を制御する。野生型のIL-21共培養でもABCsは増加する
- IL-21(受容体はIL21R+γ-chain含む)を加えてもIL-13Rα1 がないとABCの増殖は軽度にとどまる
- IL-4はABCs抑制に働く。IL-21単体よりもIL-4加えていた方がABC産出は抑制される
- IL-21 + IL-13の共培養はIL-21の結果とかわらず
- IL-21はとこで関わっているのか??
DKOとIL-13Rα1-/- DKOのABCsをRNS-seqで解析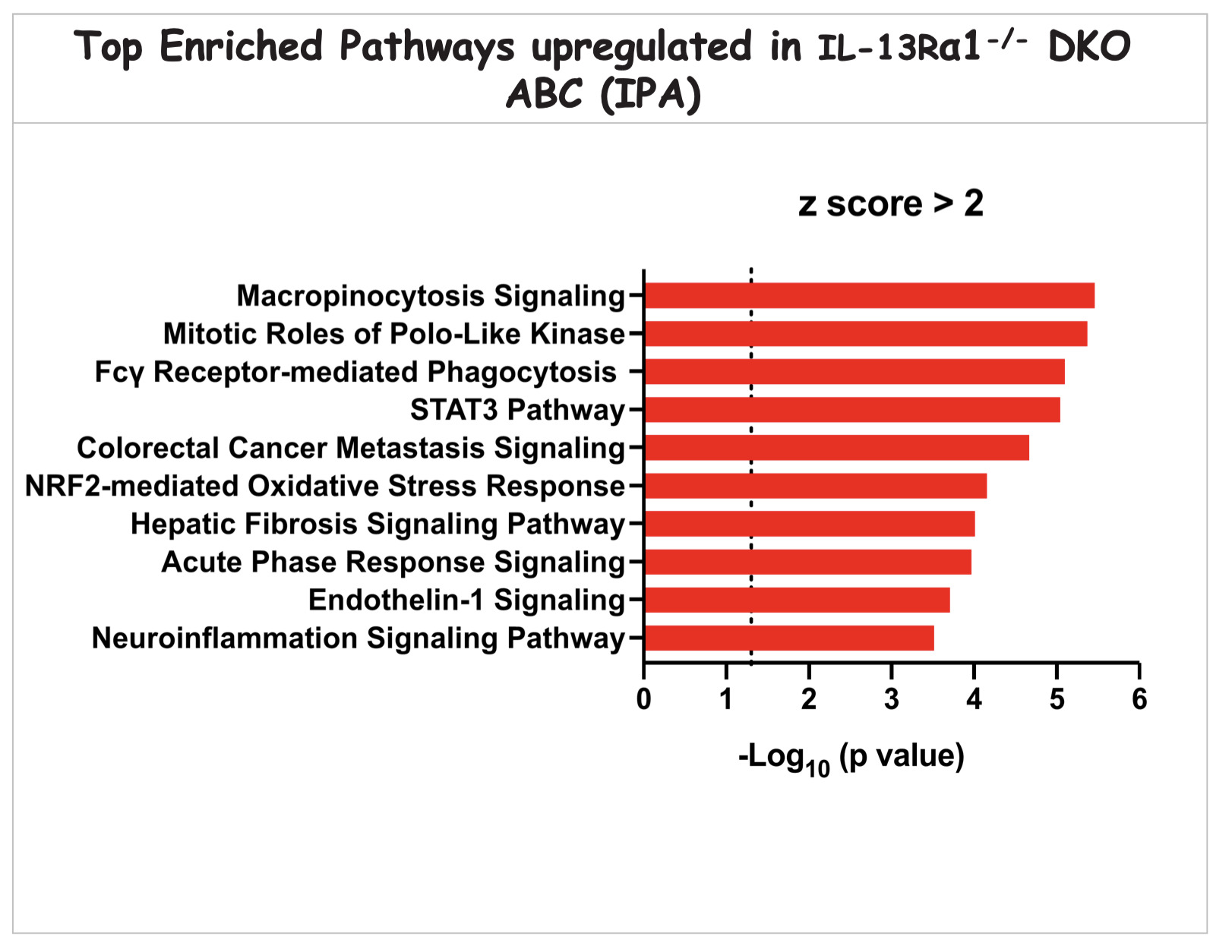
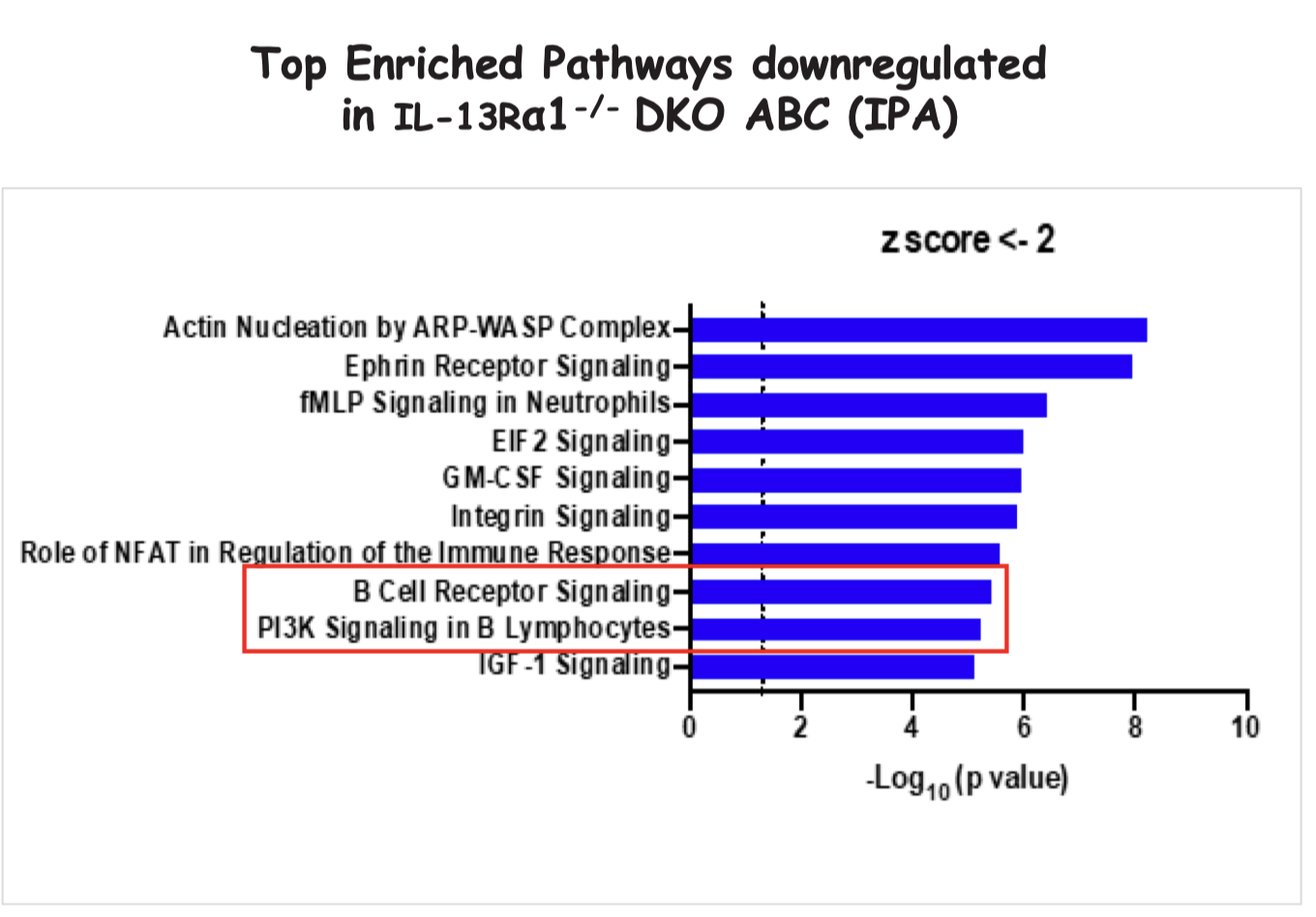
- BCRシグナリングがdownregulatedされており、抗体産出はできないのだろう
- ただし炎症性のsignatureはupregulatedされている
- だから腎障害の臓器障害はかわらなかったのだろう。





