- Therapeutic Effect of Cyclin-Dependent Kinase 4/6 Inhibitor on Dermal Fibrosis in Murine Models of Systemic Sclerosis. Arthritis Rheumatol. 2022 May;74(5):860-870.
【INTRODUCTION】
-
Systemic sclerosis (SSc)全身性強皮症は、真皮や臓器の肥厚をもたらす複雑な自己免疫性結合組織疾患である Nat Rev Rheumatol 2014;10:390–402.
-
免疫抑制剤としてmethotrexate, mycophenolate mofetil, cyclophosphamide, and rituximabなどが、progressive dermal fibrosisやinterstitial lung diseaseの治療に用いられているが、その効果は限りがあるで Ann Rheum Dis 2017;76:1327–39.
-
SScの病態においてmyofibroblasts筋芽細胞は様々な細胞外マトリックス(ECM)や炎症性分子を産生し、組織のfibrosisを誘導する重要な要素である
-
Transforming growth factor β (TGF β )はfibroblasts線維芽細胞からmyofibroblastへの分化を促進する、主要な線維化促進サイトカインであり、SSc患者の新規治療標的候補として期待されている Nat Rev Rheumatol 2014;10:706–19.
-
臨床試験にて、TGF βの3つのアイソフォームすべてを標的とする中和抗体が、SSc患者のdermal fibrosisを減弱化することが示されている J Clin Invest 2015;125:2795–807.
-
しかし、その治療効果は部分的なものであり、またTGF βには多面的な機能があるゆえ、TGF βの遮断により出血や貧血などの重大な有害事象を引き起こす可能性がある Arthritis Rheum 2007;56: 323–33.
-
SScのTGFβシグナルを標的とした有効な治療法を開発するためには、これらの有効性を高めると同時に、その副作用を軽減する戦略を採用することが必要である
-
-
これらの薬剤の副作用を増加させることなく治療効果を高める戦略の1つは、異なる作用機序をもつ別の薬剤を同時に使用することである
-
Combination therapy併用療法は、それぞれの薬剤の投与量を減らすことを可能にし、それは潜在的に副作用の減少につながる
-
したがって、TGFβシグナルを標的とすることに加えて、組織のfibrosisの促進に関与する他の経路を特定することが重要である
-
-
SScのhistologic features組織学的特徴として、皮膚病変部におけるmyofibroblasts数の増加とコラーゲン沈着がある Front Immunol 2018;9:1–22.
-
またSSc患者の 線維性皮膚病変では、特に初期のSSc患者でproliferating fibroblastが増加していることが報告されている Arthritis Res Ther 2005;7:R1113–23.
-
これらの治験からは、fibroblastsの増殖によってmyofibroblastsの増加とその後の組織線維化がSScで起こることが示唆される
-
-
細胞増殖はサイクリンとサイクリン依存性キナーゼ(CDK)の相互作用によって制御されている
-
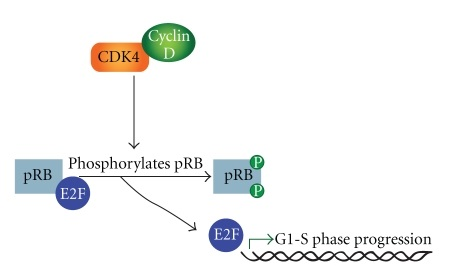
サイクリンDは、mitogenic stimulation分裂刺激に応答して、CDK4およびCDK6(CDK4/6)の活性化を促進するが、これらの2つは細胞周期におけるG1期からS期への移行を制御する重要なレギュレーターである
-
CDK4/6–cyclin D複合体は、Rbのリン酸化を触媒することでE2F標的遺伝子の転写を制限する抗増殖タンパク質であるretinoblastoma (Rb) proteinを不活性化する Ther Adv Med Oncol 2018;10:1–12.
※Wikimedia Commonsより引用
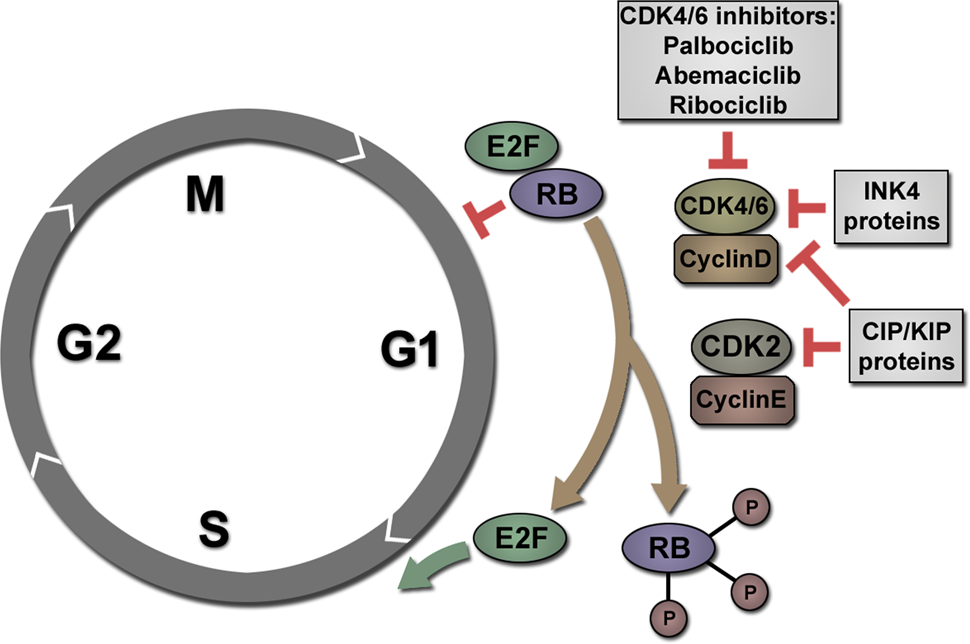
- palbociclibパルボシクリブのような選択的CDK4/6阻害剤は、進行乳がんの治療に使用されている
- CDK4/6阻害剤は、CDK4およびCDK6のATP結合ポケットに結合することにより、細胞周期の進行を抑制する Ther Adv Med Oncol 2018;10:1–12.
※ Oncogene. 2020 Jul;39(29):5165-5176. より引用
-
CDK4/6阻害剤の副作用にはneutropenia好中球減少症があるが、これは一般的に忍容性があり、投与量を減らすことで可逆的である Ther Adv Med Oncol 2018;10:1–12.
-
前臨床試験ではCDK4/6阻害剤は、以下のような非悪性腫瘍の治療にも有効であることが示されている
-
autoimmune arthritis Ann Rheum Dis 2016;75:253–9.
-
pulmonary arterial hypertension Nat Commun 2019;10:2204.
-
acute kidney injury Proc Natl Acad Sci U S A 2015;112:5231–6.
-
-
メカニズムとして、それぞれの疾患において、滑膜芽細胞、平滑筋細胞、尿細管細胞の増殖が病態に重要な役割を担っていることが明らかになった
-
注目すべきは、これらの非悪性疾患に対するCDK4/6阻害剤の必要な投与量が、悪性腫瘍の投与量よりも少ないことであり、CDK4/6阻害剤がこれらの非悪性疾患の治療に安全に使用できることが示唆されている Ann Rheum Dis 2016;75:253–9.
-
-
SSc患者の皮膚病変部ではproliferating fibroblastsの数が増加していることから、仮説としてCDK4/6阻害剤はSScのdermal fibrosisに有効であり、CDK4/6阻害剤とTGF β受容体阻害剤の併用療法は、それぞれのメカニズムを考慮すれば相加効果が期待されると考えた
本研究の目的
-
dermal fibrosisの治療における、CDK4/6阻害剤の単剤投与またはTGF βR阻害剤との併用投与の効果を調査
【MATERIALS AND METHODS】
Reagents 使用した試薬および抗体
palbociclib, galunisertib, recombinant human TGF β 1, Alexa Fluor 555–conjugated rabbit IgG and Alexa Fluor 647–conjugated rabbit IgG, α-smooth muscle actin gene, Cy3conjugated ACTA2, horseradish peroxidase (HRP)–conjugated mouse IgG and HRP-conjugated rabbit IgG, HRP-conjugated goat IgG, Alexa Fluor 488–conjugated phalloidin, DAPI, antibodies targeted against phospho-Smad2/3, Smad2/3, phospho-ERK, ERK, p38, phospho-AKT, AKT, cellular communication network (CCN) genes CCN1、CCN2, procollagen-lysine, 2-oxoglutarate 5-dioxygenase 2 gene, ysyl oxidase–like 2 gene, phosphoFAK, cadherin-11 gene, β -catenin, type I collagen, phospho-Rb, β -actin, Alexa Fluor 647–conjugated CD45, Alexa Fluor 488–conjugated vimentin, proliferating cell nuclear antigen
Human skin biopsy samples
-
びまん性皮膚SSc患者5人(女性2人、男性3人)のヒト皮膚生検をサンプルとした
-
サンプルは強皮症発症2年後に前腕部から採取
-
患者すべてはACR/EULARのSSc基準に基づき、臨床症状と組織学的所見からdiffuse cutaneous SScと診断され、他の膠原病はすべて除外されている Arthritis Rheum 2013;65:2737–47.
-
healthy controlの検体としては、性別・年齢・部位を一致させて3人(女性1人、男性2人)から採取した
Human dermal fibroblast cultures.
-
ヒトDermal fibroblastsの培養。ヒト皮膚生検標本から得たDermal fibroblastsは、以前の論文に記載された方法を用いて初代培養で分析 J Clin Invest 2004;113:253–64.
-
ヒト皮膚生検標本から得たDermal fibroblastsは、以前の論文に記載された方法を用いて初代培養で分析
-
すなわち、fibroblastは、10%ウシ胎児血清(FBS)、100単位/ml penicillin、および100μg/ml streptomycinを混入した高グルコースのDulbecco’s modified Eagle’s 培地で培養された
-
-
Dermal fibroblastsは継代3から6の間で使用された
Bromodeoxyuridine (BrdU) proliferation assay in vitro in vitroでのBromodeoxyuridine(BrdU)増殖アッセイ
-
ヒトSScfibroblastsを96ウェルプレートに2,000個/ウェルでプレーティングした
-
serum starvationの後、fibroblastをpalbociclib(CDK4/6阻害薬)またはgalunisertib(TGF β受容体阻害薬)でオーバーナイトで処理し、その後10μM BrdUで24時間処理した
-
細胞におけるBrdU取り込みの測定のための酵素結合免疫吸着法(ELISA)を行った
Immunocytochemistry.
-
Fibroblastsは4%パラホルムアルデヒドで固定して0.1% Triton Xで透過処理し、1% BSAでブロックした後,ACTA2標的抗体で染色、ファロイジン染色とDAPI染色を行った
-
ECMの解析のために、fibroblastは透過化せずに、I型コラーゲンまたはfibronectinを標的とする抗体で染色した。画像はFV10i共焦点顕微鏡を用いて得た
-
蛍光強度は、ImageJソフトウェア(National Institutes of Health)を用いて定量化された
Western blotting.
-
ウェスタンブロッティング。タンパク質サンプル(10μg)をドデシル硫酸ナトリウム-ポリアクリルアミドゲル電気泳動で分離し、PVDF膜に移した
-
ブロットを5%BSAでブロックし、一次抗体とインキュベート、その後二次抗体とインキュベートした
Mice.
-
マウスは、20~26℃、湿度30~70%の12時間明暗サイクルで、病原体を含まない特定条件下で、1ケージあたり2~4匹を飼育
HOCl-induced dermal fibrosis in mice.
-
6週齢の雌のBALB/cマウスにフレッシュに調製した、250μlのHOClを背中の2ヶ所に6週間にわたり週5日皮内注射した。コントロールとしてリン酸緩衝生理食塩水(PBS)を使用した
Bleomycin-induced fibrosis in mice.
-
ブレオマイシンをPBSに溶解し、0.5mg/mlの濃度にした。6週齢のC57BL/6マウスに、4週間毎日背中に100μlのブレオマイシンを皮内注射し、コントロールとしてPBSをコントロールとして用いた J Invest Dermatol 1999;112:456–62.
In vivo administration of a CDK4/6 inhibitor and a TGFβR inhibitor in mice. CDK4/6阻害薬およびTGFβR阻害薬のマウスへのin vivo投与
-
治療後期(fibrosis reversal)治療期には、palbociclib(用50mg/kg/day)を42日目以降毎日マウスに経口投与し、さらに3週間投与した。
-
vehicle control groupには、治療群と同用量の阻害薬無添加の溶媒を経口投与した
-
CDK4/6阻害薬およびTGFβR阻害薬のマウスへのin vivo投与。Palbociclib(CDK4/6阻害薬)は、0.5%メチルセルロースで希釈したGalunisertib(TGF βR阻害剤)は、脱イオン蒸留水中の2%DMSOおよび30%ポリエチレングリコールで希釈した
-
Palbociclib( 20 mg/kg/day又は 50 mg/kg/ day)及び/又はGalunisertib(投与量100mg/kg/日)を、同時治療期には0日目から、早期治療期には21日目から毎日マウスに経口投与した
-
サンプルサイズは、我々のパイロット実験に基づいて決定
-
マウスは無作為に各群に割り当てられた
-
治療の順番はランダムに設定した
-
マウスは毎日身体的・行動的な異常を観察し、呼吸困難の発生、食事ができない、有意な体重減少、横たわるなど、あらかじめ定められた人道的エンドポイントを超える動物がいないことを確認した
-
すべてのマウスは、過剰量のペントバルビタールで安楽死
-
分析から除外されたマウスはなし
-
マウスの皮膚組織の組織学的分析は、盲検化している
Histologic analysis of dermal fibrosis in mice.
-
HOCl-induced dermal fibrosisの21日目、42日目、63日目、またはブレオマイシン-induced dermal fibrosisの28日目に、マウスから皮膚試料を採取した
-
皮膚サンプルは10%緩衝ホルマリンで固定し、パラフィンに包埋
-
ヘマトキシリン・エオジン染色またはMasson’s trichrome染色した皮膚組織の5μm切片を盲検法で検査した
Immunohistochemistry. 免疫組織化学
-
SSc患者から得たヒト皮膚生検サンプルの免疫組織化学的分析のために、皮膚切片をphospho-Rbに対する抗体で染色後に抗体で染色を行った
-
さらに、皮膚切片をACTA2およびCCN2を標的とする抗体で染色した後2次抗体で染色した
-
Olympus BX50顕微鏡を使用して画像を撮像した
-
さらに、皮膚の切片を、CD45、ビメンチン、またはPCNAを標的とする抗体で染色し、その後に二次抗体で染色した
-
核はDAPIで染色、Olympus FV10i共焦点顕微鏡を用いて撮像した
Collagen measurement.
-
マウス皮膚の6mmパンチバイオプシーサンプルを6M HCl中で95℃、20時間加水分解した。コラーゲン含有量は総コラーゲンアッセイを用いて定量化した
Statistical analysis.
-
Bonferroni’s test、Mann–Whitney testで解析。0.05未満のP値を有意とした
【RESULTS】
CDK4/6阻害剤によるfibroblast増殖抑制とmyofibroblastsへの分化
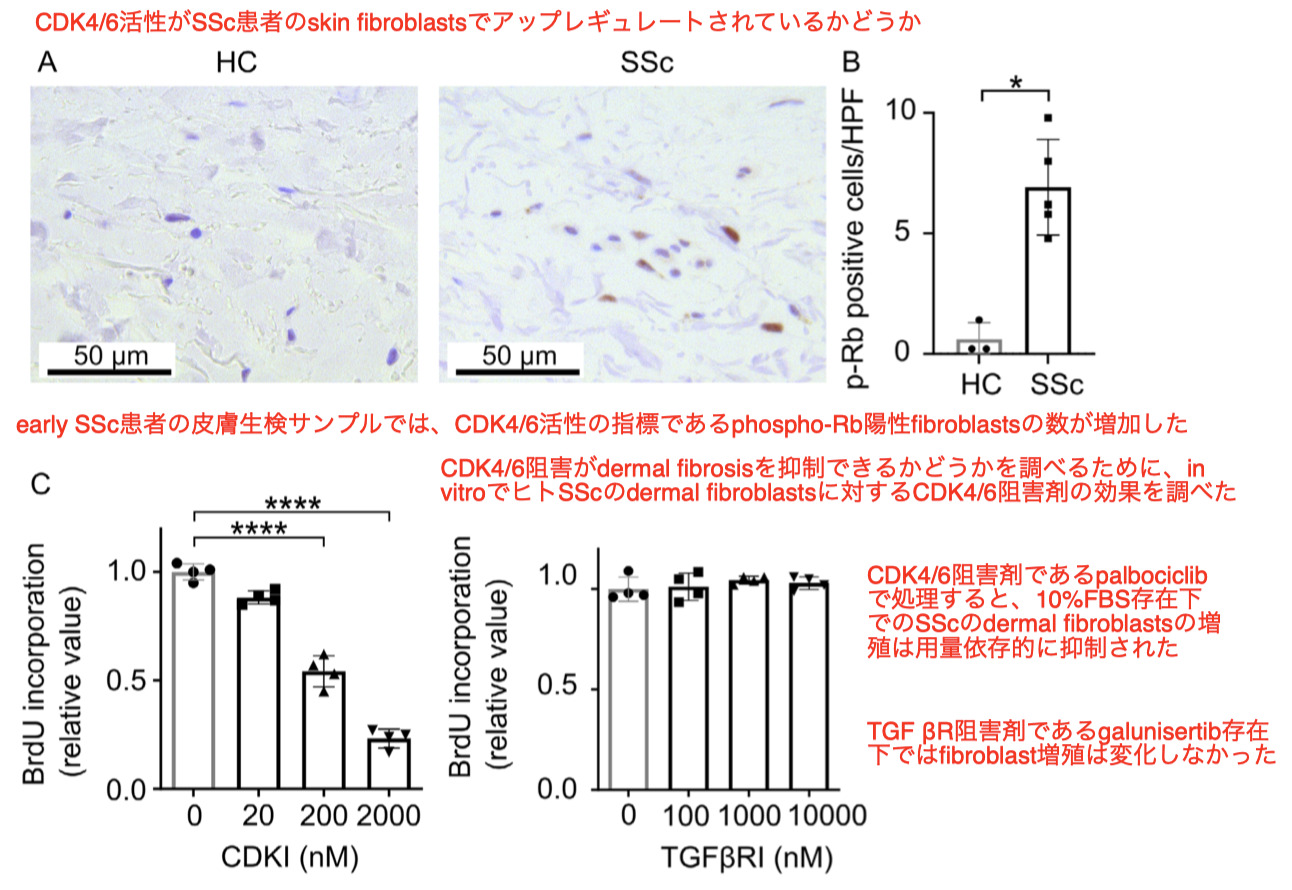
-
次に、ヒトSSc皮膚線維芽細胞の培養において、TGFβ -inducedでの fibroblastsからmyofibroblastsへの分化に対するCDK4/6阻害の影響を検討した
-
Immunocytochemical analyses免疫細胞化学的解析の結果、fibroblastの培地へのTGFβの添加により、phalloidin染色で評価したストレスフィバー形成が増加し、α-smooth muscle actin gene ACTA2の発現、細胞外I型コラーゲンおよフィブロネクチンの産出が増加し、fibroblastsがmyofibroblastsに分化したことが示唆された(Supplementary Figures ※ not shown here)
-
TGF β 受容体阻害薬で48時間処理すると (early time point) 、TGF βによるstress fiber形成、ACTA2発現、細胞外I型コラーゲンおよフィブロネクチン産出増加が抑制された(Supplementary Figures ※ not shown here)
-
CDK4/6阻害剤で処理しても、このearly time pointではTGF βによるfibroblastからmyofibroblastへの分化を抑制することはできなかった
-
-
early time pointでは、CDK4/6阻害剤による細胞数の抑制効果は見られなかったので、次に、late time pointである96時間時点でのTGF β -inducedによるmyofibroblastsへの分化に対するCDK4/6阻害剤の効果を見た
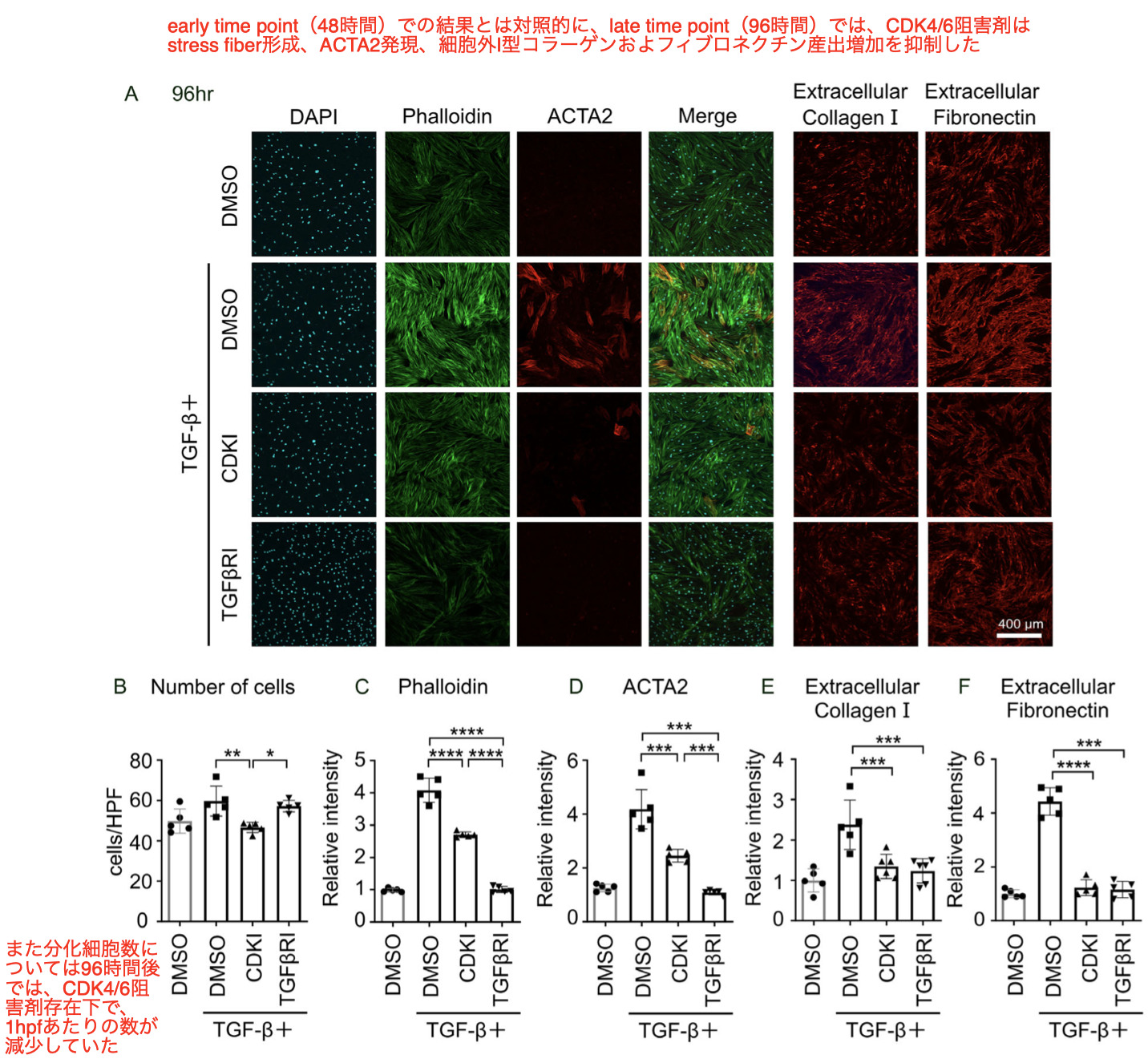
-
次にTGFβinducedのmyofibroblastへの分化の抑制過程が、CDK4/6阻害剤存在下では、TGF β R阻害剤と比較して異なるかどうかを検討した
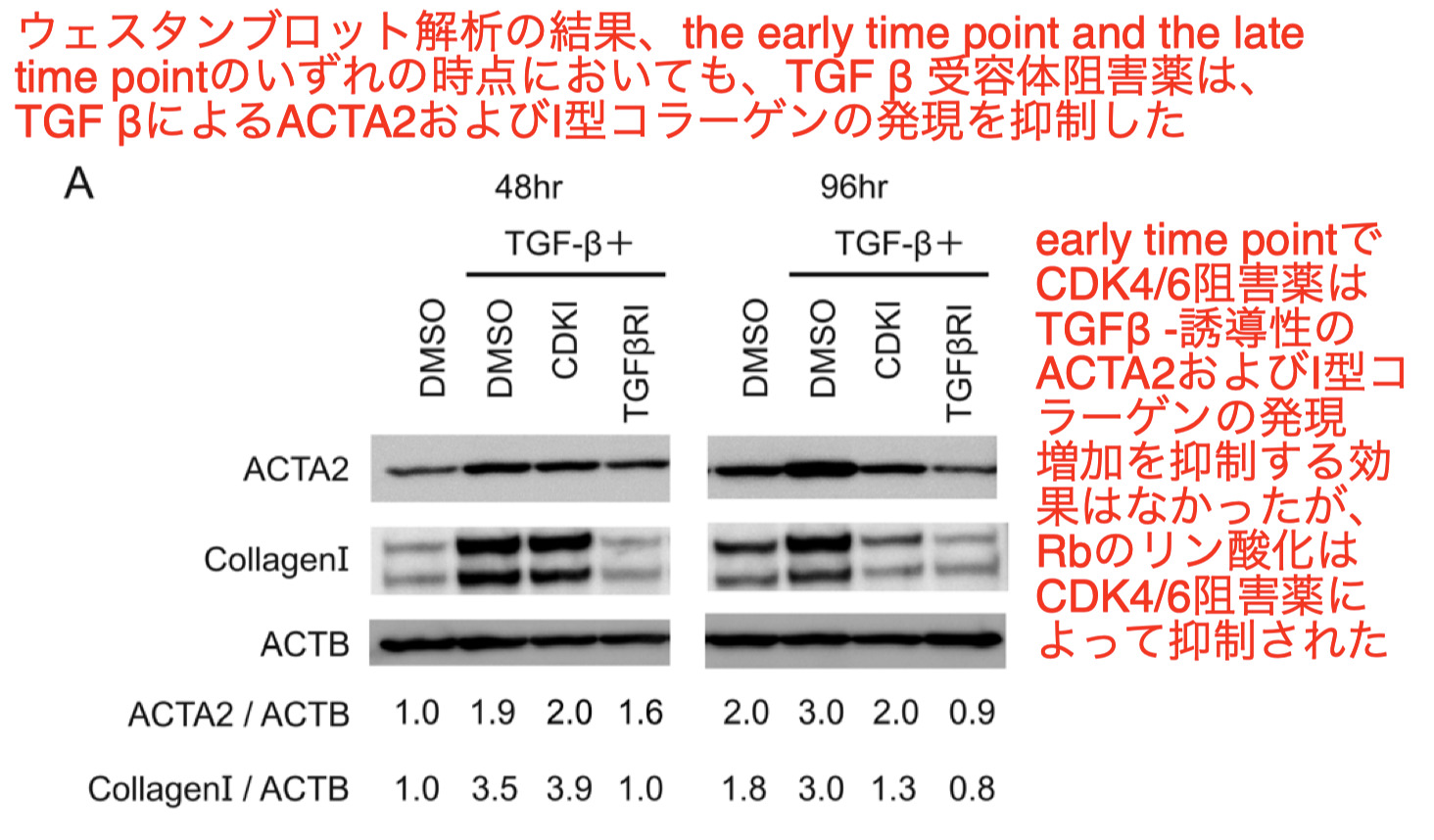
-
the late time pointではCDK4/6阻害剤処理によりACTA2およびI型コラーゲンの発現レベルが抑制されたが、その抑制効果の程度はCDK4/6阻害剤の方がTGF βR阻害剤より軽度であった
-
これらの結果は、CDK4/6阻害剤とTGF β 受容体阻害薬では、myofibroblast分化の抑制過程が異なることを示唆している
-
次に、CDK4/6阻害剤のmyofibroblastへの分化抑制効果がTGF β受容体シグナルの阻害を介したものであるかどうかを検討した
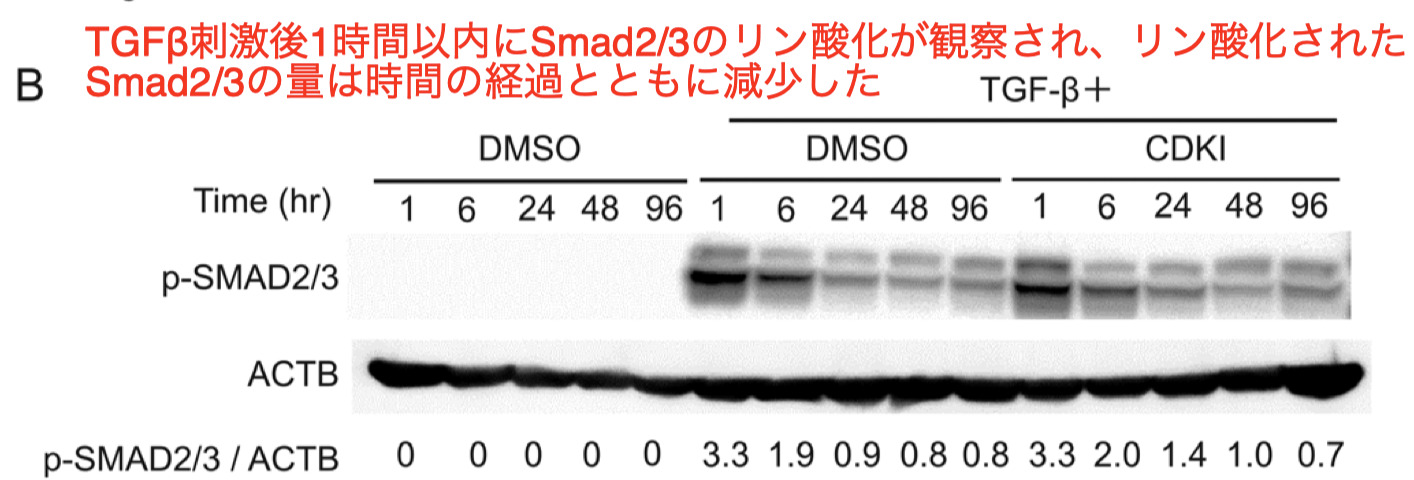
-
CDK4/6阻害剤で処理した場合、1時間から96時間のどの時点でも、TGF βによるSmad2/3のリン酸化は抑制されなかった
-
これらの結果はCDK4/6阻害薬によるmyofibroblast への分化の抑制効果は、TGF β -Smad2/3シグナリングとは無関係であることを示唆している
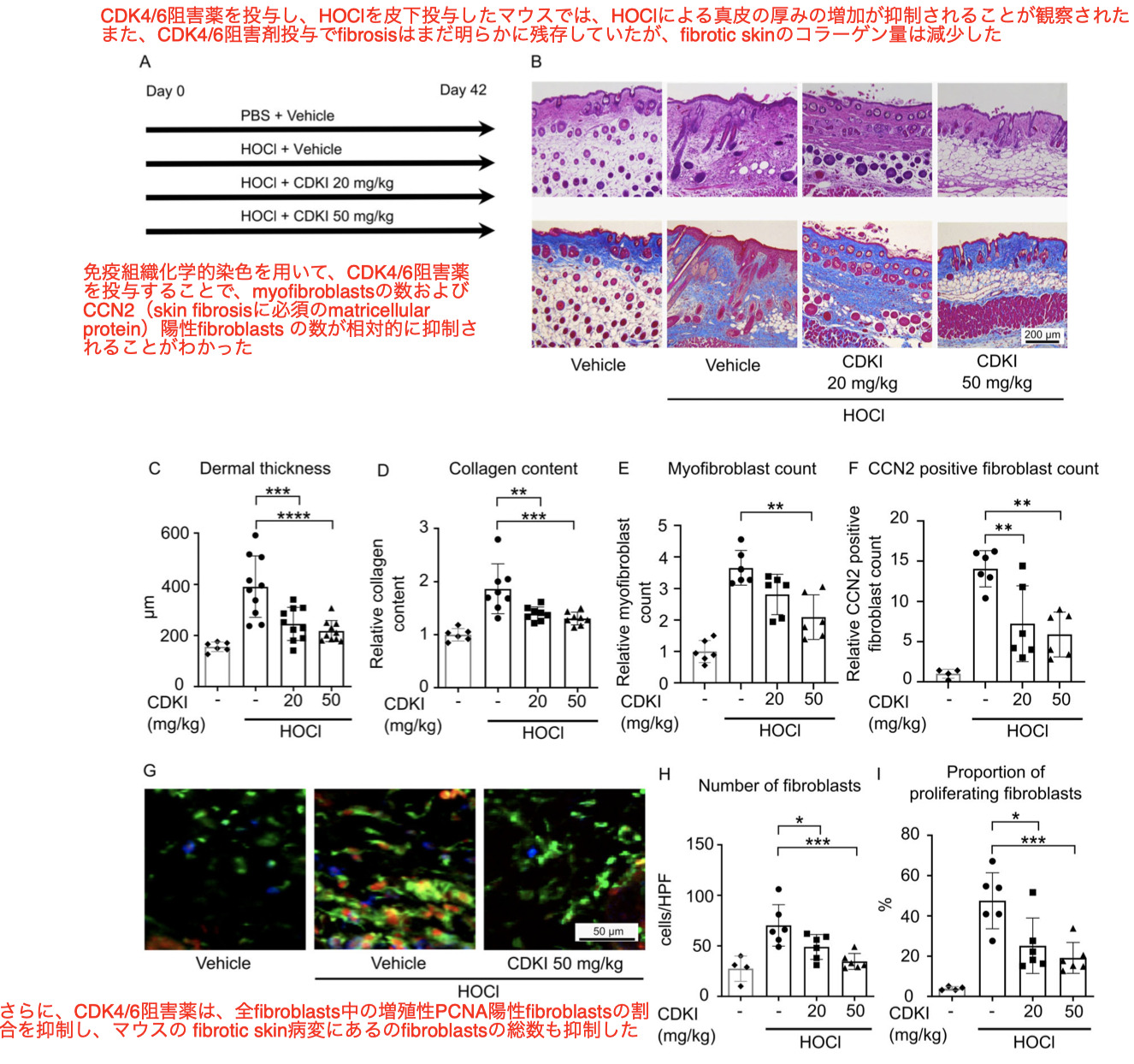
SScのマウスモデルにおけるCDK4/6阻害薬によるdermal fibrosisの抑制
- CDK4/6阻害薬がヒトdermal fibroblastの増殖とmyofibroblastへの分化を抑制することを示す説得力のあるin vitroデータを考慮し、本研究でSScのマウスモデルでCDK4/6が標的となりうるかどうかを調べた
- 著者らはこれらのマウスモデルでも、ヒト患者のSScの特徴と一致するdermal fibroblast増殖とコラーゲン沈着がの両方で観察されることから、HOCl-inducedとbleomycin-inducedのそれぞれのdermal fibrosisモデルを用いることにした Curr Opin Rheumatol 2011;23: 511–8.

-
CDK4/6阻害薬のdermal fibrosis抑制効果は、ブレオマイシン誘発dermal fibrosisモデルマウスにおいても確認された
-
またCDK4/6阻害薬を50 mg/kgの用量で投与すると真皮の厚さが減少し、CDK4/6阻害薬の両用量でコラーゲン量が減少することが実証された(Supplementary Figures ※ not shown here)
-
これらの結果と一致するように、ブレオマイシン誘発dermal fibrosisモデルマウスにおいて、CDK4/6阻害薬は、50mg/kg群におけるmyofibroblastsの相対数を抑制し、またCCN2陽性fibroblast数、fibroblast総数、及び増殖PCNA+fibroblastの割合を抑制したSupplementary Figures ※ not shown here)
-
CDK4/6阻害薬がdermal fibrosisの初期と後期の両方に有効であるかどうかに対処するために、次に、マウスのHOCl誘発dermal fibrosisモデルにおいて2つの治療フェーズをテストした(Supplementary Figures ※ not shown here)
-
早期治療段階では、dermal fibrosisが始まったばかりの21日目からCDK4/6阻害薬の投与を開始した(Supplementary Figures ※ not shown here)
-
治療後期には、42日目からCDK4/6阻害薬による治療を開始し、さらに3週間続けて、確立したdermal fibrosisにおいて、fibrosisの可逆的な効果を評価した(Supplementary Figures ※ not shown here)。
-
CDK4/6阻害薬のAntifibrotic effectsは治療早期段階で示されたが、治療後期段階では示されなかったことから、CDK4/6阻害薬はdermal fibrosisの早期段階において有効であることが示唆された
CDK4/6阻害薬とTGFβ受容体阻害薬の併用療法によるdermal fibrosisの抑制効果について、いずれかの単剤療法群と比較した場合の効果
-
CDK4/6阻害薬とTGFβ受容体阻害薬では治療作用機序が異なるため、2剤併用による治療効果は相加的なものであると予想された
-
TGFβ受容体阻害薬との併用療法において、CDK4/6阻害剤の用量を50 mg/kgとした
-
理由としてはCDK4/6阻害薬については、50 mg/kg の単剤投与ではdermal fibrosisに対する治療効果が部分的であること、50 mg/kg では好中球減少などの CDK4/6 CDK4/6阻害薬の副作用が軽度であることが示されているためである Ann Rheum Dis 2016;75:253–9.
-
TGFβ受容体阻害薬に関しては、100 mg/kgの用量を選択した
-
著者らの予備データでは、TGFβ受容体阻害薬100 mg/kgの用量によるdermal fibrosisに対する治療効果は、単独療法として投与した場合には部分的でしかないことが示唆された(Supplementary Figures ※ not shown here)
-
さらに、in vitroで使用した濃度でのCDK4/6阻害薬とTGFβ受容体阻害薬の併用では、ヒトSSc皮膚fiブロブラストにおいて細胞毒性を示さなかった(Supplementary Figures ※ not shown here)
-
HOCl-induced dermal fibrosisモデルマウスにCDK4/6阻害薬とTGFβ受容体阻害薬の併用で投与したところ、monotherapy groupまたはvehicle control groupのいずれかと比較して、併用群では、dermal thicknessの減少、マウスの fibrotic skinにおけるコラーゲン量の減少の両方でさらに治療効果が認められた(Supplementary Figures ※ not shown here)
-
またCDK4/6阻害薬単独療法群およびTGFβ受容体阻害薬単独療法群と比較して、併用療法群では、myofibroblastsの相対数、CCN2+ fibroblast数、総fibroblast数、総fibroblast中の増殖性のPCNA陽性fibroblastの割合など、いくつかの数値が低下した(Supplementary Figures ※ not shown here)
-
これらの結果はCDK4/6阻害薬とTGFβ受容体阻害薬のdermal fibroblastsに対する治療効果が、in vivoでさらにに観察されたことを示している
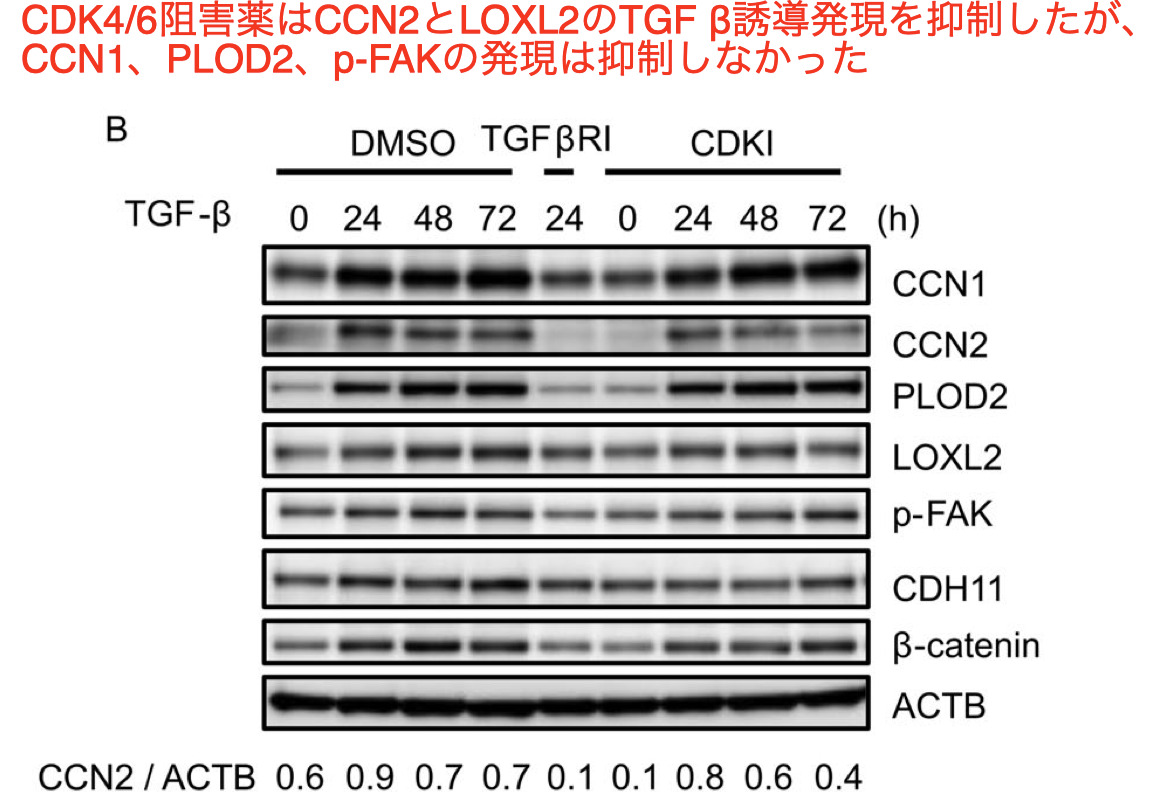
CDK4/6阻害薬によるTGFβ誘導性CCN2およびCDH11の発現の抑制
- 最後の実験として、CDK4/6阻害薬のnoncanonicalなTGFβシグナリングへの影響、例えばMAPKやphosphatidylinositol 3-kinase (PI3K) /AKTへの影響について検討した
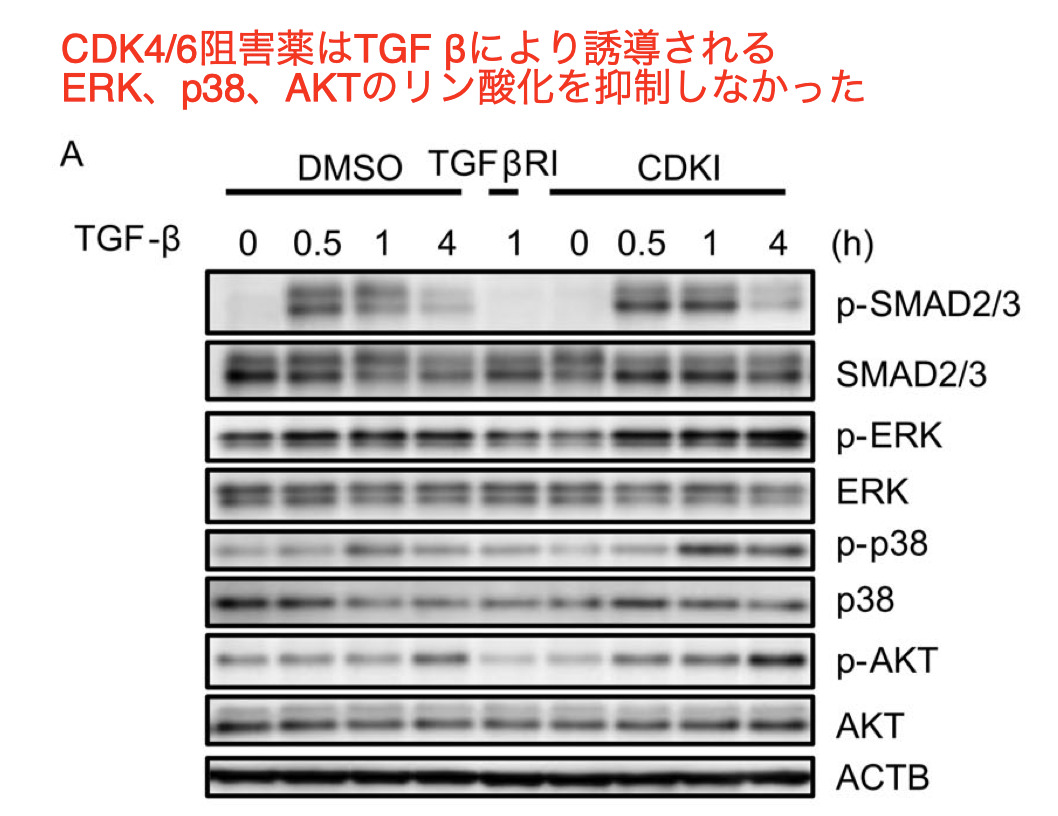
- これらの結果は、CDK4/6阻害薬のmyofibroblastへの分化抑制効果は、TGF βのcanonicalおよびnoncanonicalシなグナリングとは独立しており、CDK4/6阻害薬は、mechanotransductionや細胞間接触などの二次的TGF βシグナリングを阻害する可能性を示唆するものであった
- そこで、FAKのリン酸化(p-FAK)やCCN1、CCN2、PLOD2、LOXL2などの主要分子の発現を含むmechanotransductionの経路に対するCDK4/6阻害薬の効果を評価した Am J Physiol Cell Physiol 2020;318: C1046–54.


- TGF β -inducedでのmyofibroblast への分化には、細胞密度と細胞間接触が重要な因子である
- ゆえに、CDK4/6阻害薬投与が細胞増殖の抑制を介してmyofibroblast の分化を抑制し、それによって細胞間接触に影響を与えるかどうかを検討した
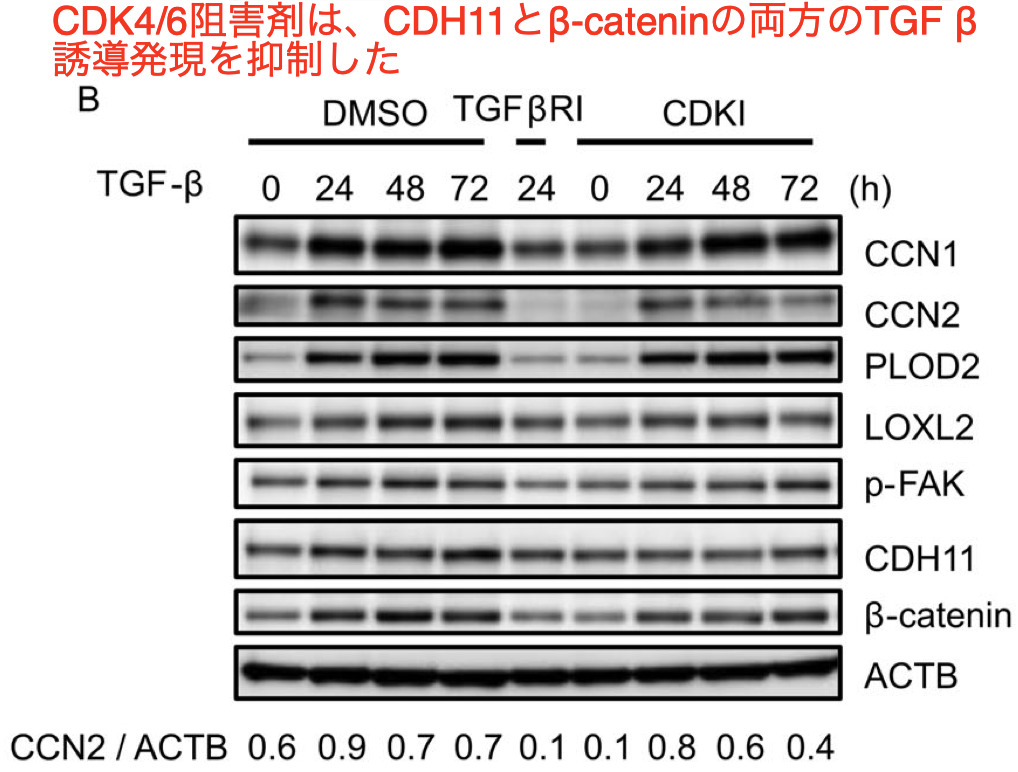
- そのため、myofibroblast への分化に重要なカドヘリンであるCDH11とその相互作用パートナーであるβ-cateninの発現に対するCDK4/6阻害薬の効果を調べた


- この結果は、CDK4/6阻害薬が細胞増殖の抑制を介して作用し、それによって細胞間接触に影響を与えることによって、myofibroblastsの分化に重要な影響を与えることを示唆している
【DISCUSSION】
-
本研究では、細胞周期の阻害がSScの新規治療戦略となり得ることが判明した
-
CDK4/6阻害薬は、TGFβのcanonicalなSmad2/3シグナルやnoncanonicalなシグナルを阻害することなく、myofibroblastの分化・ECM産生・fibroblastsの増殖を抑制した
-
In vivoにおいてCDK4/6阻害剤を単剤で投与した場合、dermal fibrosis皮膚肥厚を抑制した
-
さらに、TGFβ受容体阻害剤との併用療法では、いずれの単剤療法群と比較しても、皮膚肥厚のさらなるamelioration改善を認めた
-
-
メカニズムとしてはCDK4/6阻害剤は、myofibroblast differentiation筋芽細胞の分化と fibrosisに重要なmatricellular proteinであるCCN2および細胞接着分子CDH11の発現を抑制した
-
これらの結果は、CDK4/6阻害剤がSScの治療のための新規薬剤となり得ること、そしてCDK4/6阻害剤はTGF β受容体阻害剤と併用できる可能性があることを示している
-
-
本研究ではCDK4/6阻害剤によるmyofibroblast分化抑制効果は、dermal fibrosis促進における主要なTGF β経路であるSmad2/3シグナルとは無関係であることが明らかとなった
-
TGFβ誘導によるmyofibroblast分化に対するCDK4/6阻害剤の抑制効果は、48時間後の培養では観察されなかったが、96時間後の培養で明らかになり、この時点でcell–cell contact細胞-細胞間の接触が増加した
-
dermal fibrosisではこの細胞間接触が重要な役割を果たすことが報告されている
-
例えば、myofibroblastsへの分化に続いてfibroblastsにおけるCDH11の発現が増加し、これが筋芽細胞の接着と収縮に寄与していることが判明した Mol Biol Cell 2004;15:4310–20.
-
-
SScのin vivoモデルマウスでは、CDH11の欠損やモノクローナル抗体による遮断により、dermal fibrosisが抑制された PLoS One 2017;12:1–9.
-
-
これらの結果と一致するように、本研究は、CDK4/6阻害剤がTGFβ誘導によるCDH11とその相互作用パートナーであるβ-カテニンを抑制することを示した
-
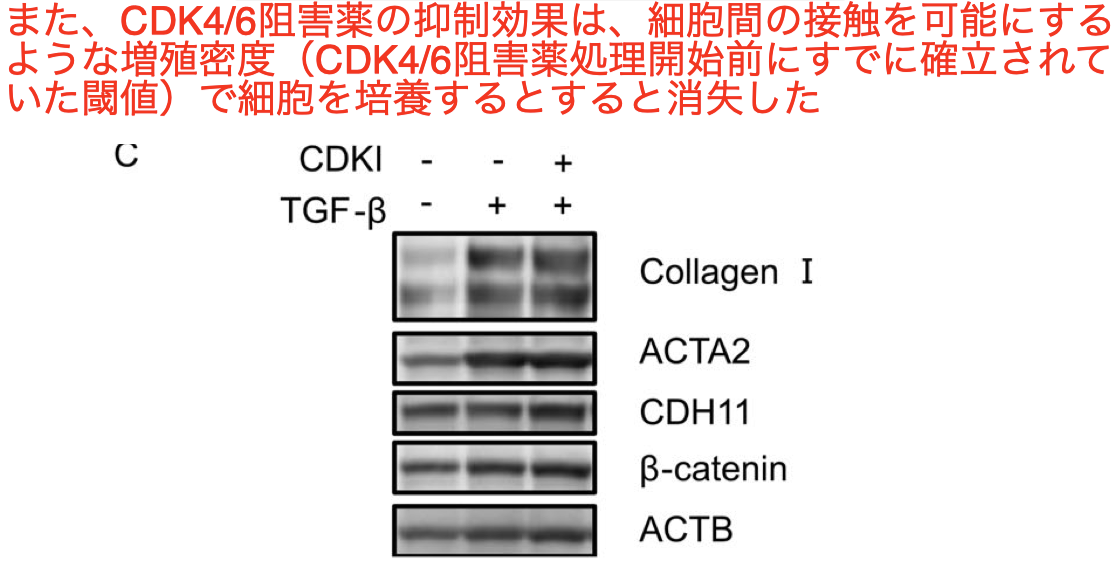
さらに、CDK4/6阻害剤は、少なくともin vitroでは、細胞gが合流に達している培養条件(細胞間接触が既に確立されている状態)で処理を開始した場合には、それ以上の効果を示さなかった
-
細胞間接触を阻害し、それに伴うfibroblastの数の減少するという現象はCDK4/6阻害剤がin vivoでのmyofibroblast differentiation とdermal fibrosisを抑制するメカニズムの1つである可能性がある
-
noncanonicalなTGFβ経路の阻害もまた、CDK4/6阻害剤がmyofibroblast differentiation とdermal fibrosisを抑制するメカニズムなのかもしれない
-
-
tissue fibrosisの促進に関与するTGFβの主要経路はSmad2/3シグナリングであるが、non-Smad2/3 pathwaysである以下の経路もまた fibrosisに関わることが知られている Semin Cell Dev Biol 2020;101:115–22.
-
ERK ・・・CDK4/6阻害剤の関与なし Ann Rheum Dis 2015;74:1408–16.
-
p38 ・・・CDK4/6阻害剤の関与なし PLoS One 2017;12:1–9.
-
JNK Ann Rheum Dis 2012;71:737–45.
-
PI3K/AKT/ mechanistic target of rapamycin ・・・CDK4/6阻害剤の関与なし J Dermatol Sci 2014;76:104–11.
-
JAK/STAT Arthritis Rheum 2012;64: 3006–15.
-
RhoA/Rho kinase Exp Lung Res 2016;42:44–55.
-
AMP-activated protein kinase Nat Med 2018;1:1.
-
-
CDK4/6阻害剤がERK、p38、PI3K/AKTシグナルに干渉しないことを実証した
-
さらに、CDK4/6阻害剤は、TGFβによるmechanotransduction機械的シグナル伝達に重要な分子であるCCN2の発現を抑制することも明らかにした Opin Rheumatol 2018;30:581–7.
-
CCN2は、ECM、分泌タンパク質、細胞表面受容体間のシグナル伝達を調整するマトリックス細胞タンパク質であり、fibrosisに重要である Am J Physiol Cell Physiol 2020;318: C1046–54.
-
-
SScのマウスモデルでCCN2遺伝子ノックアウトと抗CCN2モノクローナル抗体を用いた最近の研究から、CCN2がskin fibrosisに必須であり、fibrosis の予防のための有望な薬剤標的であることが明らかになった Arthritis Res Ther 2017;19:134.
-
CDK4/6阻害剤によるCCN2の阻害もまた、CDK4/6阻害剤のantifibrotic effectsに寄与している可能性がある
-
-
先行研究では好中球やリンパ球などの免疫細胞よりもfibroblastの方がCDK4/6阻害剤に対して感受性が高いことが示唆されている Ann Rheum Dis 2016;75:253–9.
-
関節リウマチのモデルマウスにおいて、50 mg/kgのCDK4/6阻害剤投与による末梢好中球数の減少はmildな程度であり、関節炎の明らかな改善と比較して対照的であった
-
In vitroでは、CDK4/6阻害剤でfibroblastの増殖を抑制する濃度でCDK4/6阻害剤を使用した場合、関節炎マウスのリンパ節由来細胞の抗原特異的な増殖は抑制されないことが確認された
-
本研究でののSScモデルマウスでCDK4/6阻害剤を投与すると、増殖するfibroblastとmyofibroblastの数が減少したことから、fibroblastがSScにおけるCDK4/6阻害剤の主要な標的細胞であることが示唆された
-
我々は、in vitroで2μMの濃度のパルボシクリブがantifibrotic作用を有することを証明した
-
さらに、in vivoではpalbociclibが予防効果だけでなく、早期の治療効果を発揮することも観察された
-
Palbociclibは治療後期には dermal fibrosisを回復させることができず、これは臨床における我々の観察と一致している
-
palbociclibはCDK4/6に対して高い選択性を持つが、より高い濃度で他のCDKに影響を与える可能性がある
-
Weiらの研究では非定型CDKであるCDK5(サイクリンではなくp35と相互作用する)がSScで活性化していること、pan-CDK阻害剤の一つであるroscovitineがCDK5/p35の阻害を介してTGFβ-仲介の線維化過程を抑制したことが、研究成果として明らかになっている Oncotarget 2018;9:10294–306.
-
-
palbocicliを介したantifibrotic effectsにおけるCDK5/p35の関与は考えにくい Cancer Cell 2018;34:9–20.
-
理由としては、cell-freeに対するCDK5に対する阻害濃度は10μM以上であるのに対し、CDK4/6に対する阻害濃度は0.26μMであるためである
-
-
Limitations
-
ヒトSScのdermal fibroblastsを用いるin vitro実験や、SScのマウスモデルを用いるin vivo実験では、ヒトSScの病態のすべての側面を完全に再現できない
-
CDK4/6阻害剤として使用した場合、パルボシクリブのin vitroおよびin vivoでのoff-target effectsの寄与の可能性を排除することができない
-
※ off-target effects: 本来の標的(on-target)とは異なる別の分子(off-target)を阻害してしまうこと
-
-
前臨床試験で観察された治療効果と乳癌治療におけるCDK4/6阻害剤の安全性プロファイルを考慮すると、SSc患者におけるCDK4/6阻害剤の臨床試験が必要であると考えられ、そうすることで、ヒトSScにおけるこの治療戦略の効果を確認できるだろう