
Anti-TIF1-γ autoantibodies: warning lights of a tumour autoantigen Rheumatology (Oxford). 2020 Mar 1;59(3):469-477.
【Rheumatology key messages】
- Anti-transcription intermediary factor 1-γ autoantibodies 抗TIF1-γ抗体はがん関連DMと強く関連している
- TIF1-γは癌の発生に関連するいくつかの経路に関与している
- 抗TIF1-γ抗体はanti-tumour response抗腫瘍反応や筋肉・皮膚のダメージの両方と関連している
【Introduction】
-
Idiopathic inflammatory myopathies (IIMs)特発性炎症性ミオパチーは全身性自己免疫疾患であり、主にmuscle inflammation (myositis)筋炎 と weakness筋力低下を特徴とする
-
IIM患者ではまた、皮膚症状、関節炎や関節痛、間質性肺疾患、消化器疾患や心疾患も認められる
-
IIMの有病率は10万人あたり2.4~33.8人と推定され、年間発症率は100万人あたり1.16~19人 Rheumatology (Oxford) 2015;54:50–63.
-
女性の割合が多く、北半球では緯度が高いほど発生率が低い Arthritis Res Ther 2018;20:117.
-
IIMの異なるsubtypesとして、PM, DM, IBM、免疫介在性壊死性筋炎、オーバーラップ筋炎(抗シンテターゼ症候群を含む)があるが、すべてのsubtypeに対する特定の分類基準に関するコンセンサスはまだ報告されていない Arthritis Rheumatol 2017;69:878–84.
-
IIMsすなわち筋炎はがんと強く関連している Lancet 2001;357:96–100.
-
IIM患者におけるがんの有病率は6.7~32% Front Immunol 2017;8:992.
-
主にDM患者(最近のメタアナリシスではがん発生の標準化罹患率5.5)で報告があるが、免疫介在性壊死性筋炎では少ない Arthritis Res Ther 2017;19:259.
-
癌の発見と密接な時間的関係があるため、筋炎と癌はmechanisticallyに関連していることを示唆されており、筋炎での免疫抑制剤使用による癌の関連は否定されている
-
癌の治療が成功した後に筋炎が消失することがあるため、paraneoplastic phenomenonとして筋炎を認めているのかもしれない
-
しかし、筋炎はしばしば癌の診断後に現れ、その間隔は様々であり、関連する癌を適切に治療した後でも、治療抵抗性の経過となることがある Curr Rheumatol Rep 2011;13:208–15.
-
Myositis-specific autoantibodies (MSAs)筋炎特異的自己抗体は、IIM患者の60-70%で同定される Nat Rev Rheumatol 2018;14:290–302.
-
MSAは通常、細胞質または核分子に関与し、タンパク質合成、転位、遺伝子転写やウイルス認識など、重要な生物学的プロセスの制御に関する機能を果たしている
-
各々の自己抗体は、特定の疾患の症状・転帰・治療戦略の成功に関連している Nat Rev Neurol 2011;7: 343–54.
-
現在知られているMSAは以下の通り Arthritis Res Ther 2011;13:209. Curr Rheumatol Rep 2013;15:335.
-
Anti-Jo-1
-
anti-Mi-2
-
anti-melanoma differentiation-associated gene 5 (MDA5) 抗黒色腫分化関連遺伝子
-
anti-signal recognition particle (SRP) 抗シグナル認識粒子
-
anti-nuclear matrix protein 2 (NXP2) 抗核マトリックスタンパク質
-
anti-transcriptional intermediary factor 1 (TIF1)-γ 抗転写中間因子
-
anti-small ubiquitin-like modifier activating enzyme (SAE) 抗小型ユビキチン様修飾因子活性化酵素
-
anti-3-hydroxy-3-methylglutaryl-coenzyme A reductase (HMGCR)抗3-ヒドロキシ-3-メチルグルタリル・コエンザイムA還元酵素
-
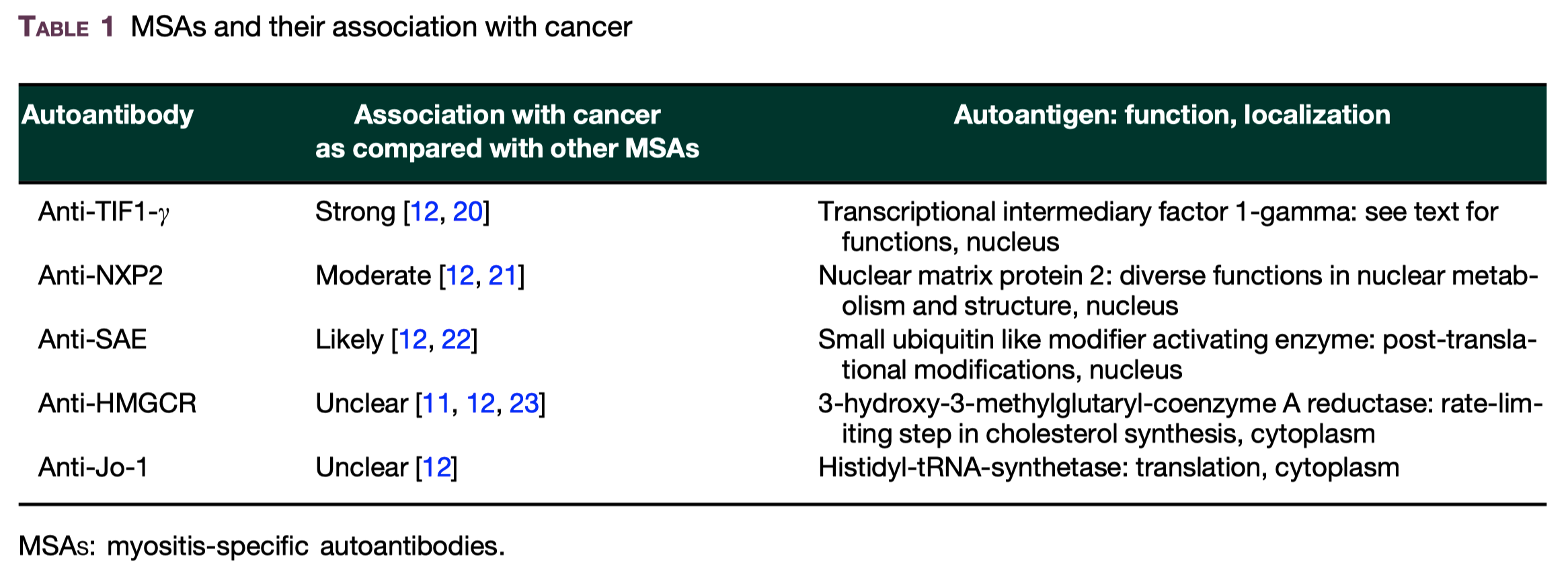
-
anti-TIF1-γ, anti-NXP2 and anti-HMGCR autoantibodiesはIIM患者のがんリスク上昇と関連する Brain 2016;139:2131–5. Arthritis Res Ther 2017;19:259.
-
特に抗TIF1-γ陽性患者の84%まで、癌関連のDMを発症している Arthritis Rheum 2013;65: 2954–62.
-
一方、juvenile DM 若年性DM患者ではこのような癌との関連はない
-
抗TIF1-γ自己抗体は、Targoffらによってimmunoprecipitation免疫沈降法により発見された Arthritis Rheum 2006;54:3682–9.
-
標的抗原は 155 kDa の核タンパク質であり、後に TIF1-γ であることが同定
-
TIF1-αを抗原とする140 kDaのバンドもimmunoprecipitation免疫沈降法により検出されたが、この二重反応性に関してはTIF1-γが主要な標的であると思われるが、TIFファミリーの異なるタンパク質に対する交差反応性を示唆している
-
このレビューの目的
- TIF1-γの正常生理学及び癌に関する機能を要約
- この自己抗原がなぜ癌と関連するのか、そして抗腫瘍反応がどのようにDMにつながるのかについての概要を示すこと
TIF1-γ in a physiological context 生理的な状況におけるTIF1-γ
-
ヒトのTIF1-γは1999年にVenturiniらによって初めて報告されており、ectodermin エクトデルミン, RET-fused gene 7 protein, ripartite motif (TRIM) 33 としても知られている Oncogene 1999;18:1209–17.
-
TIF1-γは、1番染色体短腕のp13バンド上に位置するTRIM33遺伝子によってコードされており、
-
TIF1-α (TRIM24), TIF1-β (TRIM28) , TIF1-δ (TRIM66), TIF1-γ で構成されうる TIF1 familyの一つである
-
TIF1-γは骨格筋や皮膚などの正常組織にも存在しており、組織によってRNAやタンパク質の量は異なる
-
-
TIF1-γの生物学的な関与 Mol Cell 2011;43: 85–96.
-
DNAのプロモーター領域で転写複合体にリクルートされると、転写を抑制または活性化することができる
-
翻訳後修飾によってタンパク質の機能・局在・分解に寄与している
-
E3 ubiquitin-protein ligase と small ubiquitin-like modifier (SUMO) E3 ligase activity がある
-
TIF1-γl自体もsumoylationなどの翻訳後修飾によって調節されている
-
TRIM33遺伝子のプロモーターのmethylationによって発現が抑制される J Clin Invest 2011;121:2361–70.
-
-
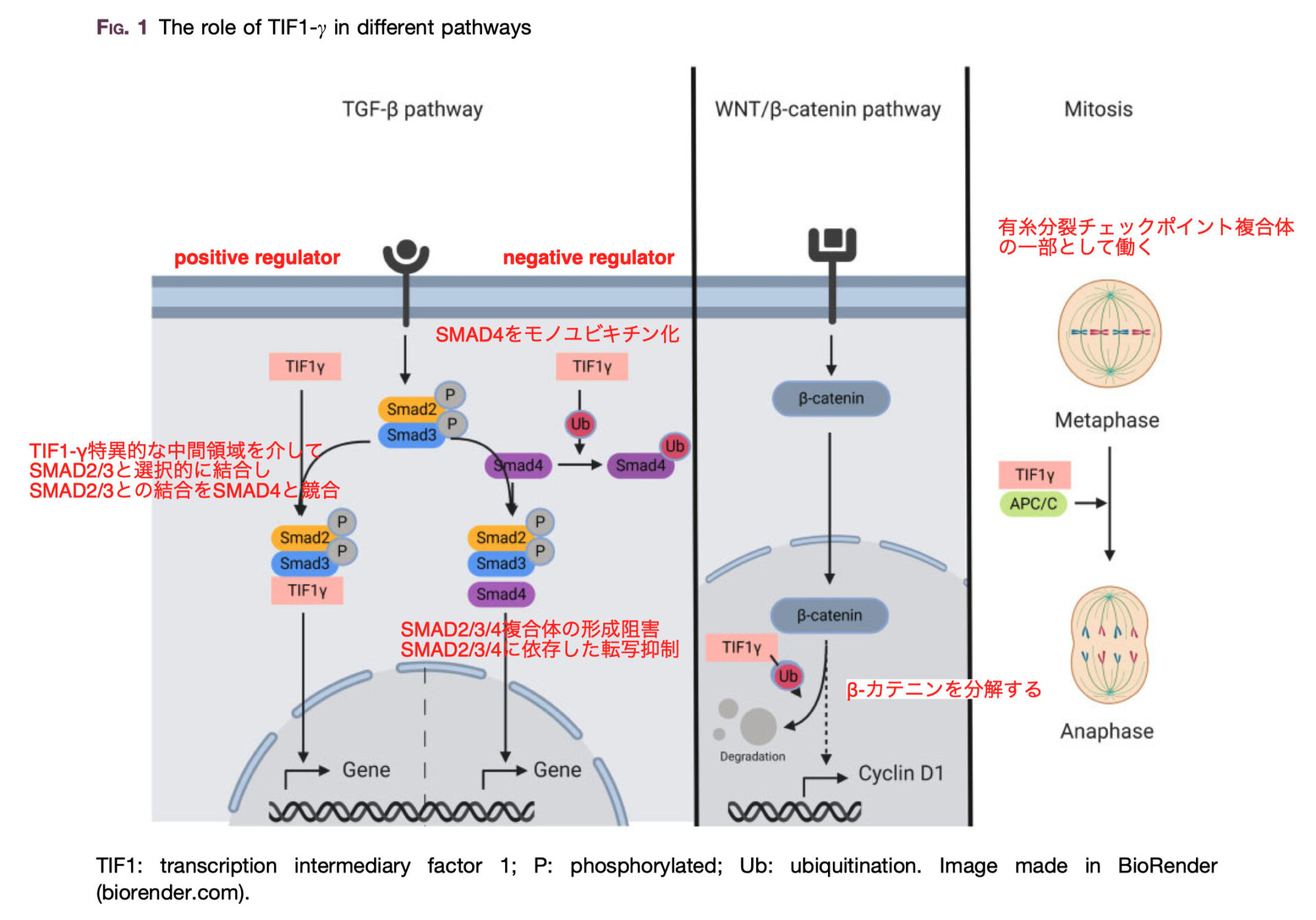
TGF-β signalling pathway
-
cell differentiation細胞の分化・proliferation増殖・developmental processes発生プロセス、tissue homeostasis組織のホメオスタシスに不可欠
-
細胞の状況に応じて、TIF1-γは標準的なSMAD依存性TGF-β経路のnegative regulatorまたはpositive regulatorとして働く PloS One 2012;7:e33761. Dev Cell 2006;10:685–6.
-
SMADはcytoplasmic molecules細胞質分子であり、TGF-β受容体の活性化によって複合体に集合し、核に移動して転写因子として働く
-
TIF1-γはnegative regulatorとしての役割がある Cell 2005;121: 87–99.
-
SMAD4をモノユビキチン化
-
SMAD2/3/4複合体の形成阻害
-
SMAD2/3/4に依存した転写抑制
-
この抑制機構は、幹細胞や胚の発生過程において確認されている Mol Cell 2011;43: 85–96. FEBS Lett 2012;586:1913–20.
-
-
TIF1-γは、positive regulatorとしての役割もある
-
TIF1-γ特異的な中間領域を介してSMAD2/3と選択的に結合
-
SMAD2/3との結合をSMAD4と競合
-
-
SMAD4非依存的なシグナル伝達は造血系で報告されている
-
SMAD2/3-TIF1-γ複合体の形成は赤血球分化を促進
-
SMAD2/3/4複合体は赤血球増殖を阻害する Cell 2006; 125:929–41.
-
-
またSMAD2/3-TIF1-γ複合体は、乳腺上皮細胞の終末分化と授乳を促進する Development 2013;140:167–75.
-
-
-
-
TGF-β signalling pathway以外の役割
-
TIF1-γは有糸分裂チェックポイント複合体への参加やβ-カテニンを分解するなど、細胞周期に関連するプロセスにも関与 Nat Commun 2015;6:6156. Oncogene 2013;32:4622–33.
-
骨芽細胞の増殖と分化、DNA修復 J Biol Chem 2013;288: 32357–69.
-
TIF1-γはマクロファージの活性化 Nat Commun 2015;6:8900.
-
inflammasome complex formationインフラマソーム複合体の形成 を通じて、免疫反応にも積極的に関与
-
腫瘍形成 J Immunol 2014;193:3676–82.
-
TIF1-γ and cancer TIF1-γとがん
-
TIF1-γは腫瘍抑制因子としても促進因子としても働く
-
研究の多くがマウスやヒトの悪性腫瘍において、TIF1-γが腫瘍抑制因子であると報告している Nat Commun 2015;6:6156. Exp Hematol 2016;44:727–39.e6.
-
-
TIF1-γは、上記に示した様に、TGF-β伝達経路における主にSMAD4のモノユビキチン化を介したTGF-β-induced epithelial-to-mesenchymal transition TGF-β誘導上皮間葉転換の阻害によって腫瘍形成を阻害する
-
hypermethylation, histone modifications, short non-coding microRNA or sumoylationによって、TIF1-γが不活性化・変異・ダウンレギュレーションし、腫瘍抑制因子の効果が低下し、腫瘍形成を促進しうる Am J Pathol 2012;180: 2214–21.
-
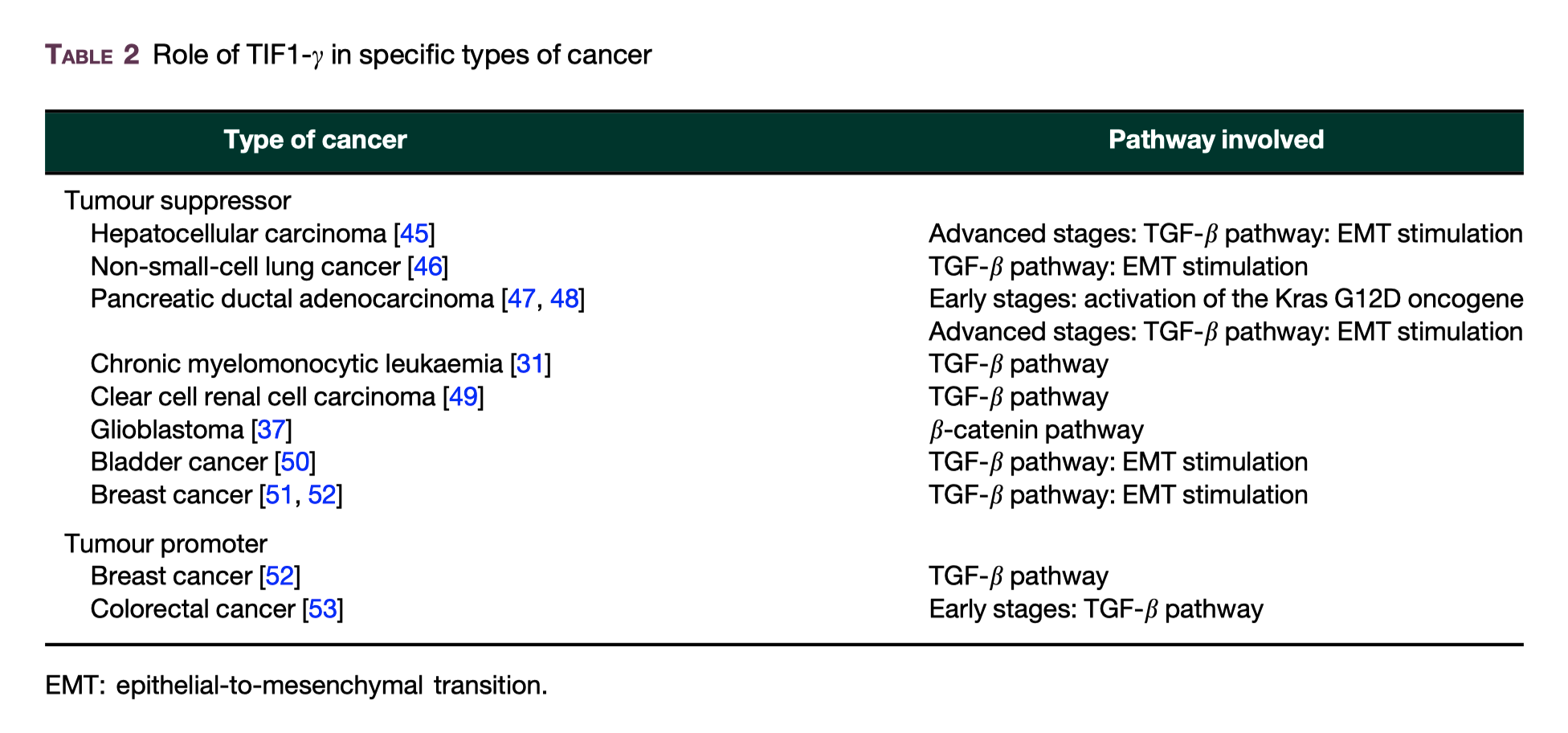
このことは以下のがんで報告されている
-
hepatocellular carcinoma 肝細胞癌 Oncogene 2016;35:867–77.
-
chronic myelomonocytic leukaemia 慢性骨髄単球性白血病 J Clin Invest 2011;121:2361–70.
-
non-small-cell lung cancer 非小細胞肺癌 Oncogene 2016;35:867–77.
-
bladder cancer 膀胱癌 Oncol Rep 2016;36:1535–41.
-
breast cancer 乳癌 EMBO Rep 2011;12:665–72. BMC Cancer 2015; 15:453.
-
pancreatic ductal adenocarcinoma 膵管腺癌 PLoS Genet 2009;5:e1000575.
-
-
SMAD4 欠損の膵臓癌細胞において、SMAD4 非依存の腫瘍抑制効果が報告されており、別の経路を介した TIF1-γ の腫瘍抑制効果を示唆している Am J Pathol 2012;180: 2214–21.
-
別の経路として考えられているものがWnt/β-カテニン経路
-
Wnt活性化によってβ-カテニンがCyclinD1の誘導をするが、TIF1-γはβ-カテニン分解への寄与によって腫瘍抑制因子として作用する。
-
Cyclin D1はその名のとおり細胞分裂周期に深く関わっており、いろいろな腫瘍で高発現している。リンパ腫に関しては、マントル細胞リンパ腫が有名。他に骨髄*腫
-
-
glioblastoma膠芽腫のようなある形態をとるヒトの癌は、β-カテニンの異常なまたは持続的な活性化がおこっている Nat Commun 2015;6:6156.
-
-
TIF1-γの長期の不活性化は、mitotic defects有糸分裂の欠損、chromosomal abnormalities染色体異常、increased tumour aggressiveness腫瘍の攻撃性の増加をもたらし、別の腫瘍抑制機構を示唆している Cancer Res 2015;75:4335–50.
-
TIF1-γは主に腫瘍抑制因子として研究されているが、(SMAD4の欠損を伴う)TIF1-γの過剰発現が早期乳癌、早期および進行期の大腸癌で報告されている BMC Cancer 2015; 15:453. World J Gastroenterol 2011;17:3994–4000.
-
TIF1-γは、これらの細胞において、TGF-βシグナルによるSMAD4を介したアポトーシス効果を阻害することで、aberrant cells異常細胞(ここでは癌細胞)のアポトーシスを減少させる
-
TGF-βによるアポトーシスと上皮間葉転換の制御に関して、この2つの事象はparadoxical逆説的に思えるが、どちらに働くかはおそらくcell cycle phase細胞周期に関連している Cell Res 2007;17:289–90.
-
childhood papillary thyroid carcinoma小児甲状腺乳頭癌やlung adenocarcinoma肺腺癌でも報告されているが、DNA損傷による腫瘍形成促進状況におけるTIF1-γの特異的役割は、TRIM33-RET融合オンコプロテイン(癌蛋白質)の一部としての役割 Cancer Discov 2013; 3:630–5.
-
しかしながらRET遺伝子は既知のproto-oncogene癌原遺伝子であり、腫瘍促進に働く。TRIM33とRET遺伝子が融合することによるシナジー効果を除外することはできないが、TRIM33遺伝子も原因となっているのかもしれない
-
-
IF1-γがなぜ、どのように抗TIF1-γ自己抗体の形成とがん患者におけるDMの発症をもたらすかは、別の問題
Pathogenic mechanisms in anti-TIF1-γ-positive cancer-associated DM 抗TIF1-γ陽性がん関連DMの発症メカニズム
-
myositisの基礎にある正確な病因は未だ不明であるが、adaptive適応免疫とinnate自然免疫の両方が筋炎の病因に関与していると考えられており、autophagyオートファジー、endoplasmic reticulum stress-response小胞体ストレス応答、hypoxia低酸素の関与が報告されている Clin Rev Allergy Immunol 2017;52:58–70.
-
抗TIF1-γ陽性癌関連DMでは、癌がDMのトリガーとなり、TIF1-γが腫瘍の自己抗原として機能していると考えられる Arthritis Rheum 2012;64:346–9.
-
TIF1ファミリータンパク質が腫瘍自己抗原である可能性を裏付ける証拠が、最近Pinal-Fernandezらによって示された Rheumatology (Oxford) 2018;57:388–96.
-
彼らは、癌に関連したDM患者において、初めてTIF1遺伝子の遺伝子変化を記録
-
Loss-of-heterozygosityヘテロ接合性の消失が検出された。
-
1例では癌関連筋炎患者の腫瘍でTIF1対立遺伝子にsomatic mutation体細胞突然変異が検出された。
-
TRIM33の突然変異はまれであり(全癌の1%未満)、その機能は、driver mutationsドライバー変異としてなのか、腫瘍の発生における変異の積み重ねの要素の一部分として作用するのかは分からない
-
-
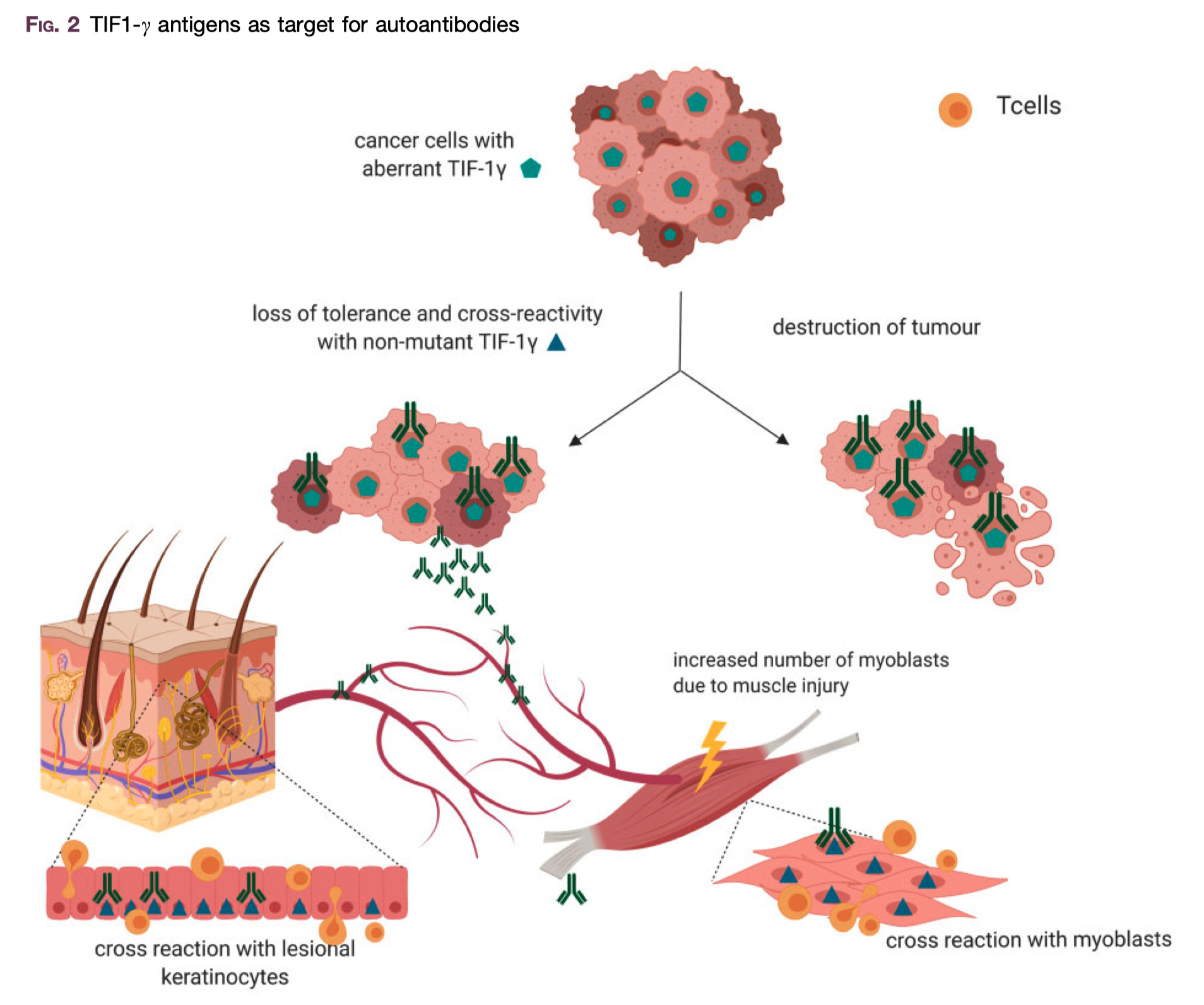
TIF1-γの変異によって、neoantigen formationがん抗原が形成され、適応的及び自然免疫的な抗腫瘍反応を活性化する可能性がある。
-
この抗腫瘍反応によって、腫瘍の根絶あるいは、腫瘍抗原の除去のみ がもたらされるかもしれない
-
腫瘍の根絶の役割に関しては、癌を持たない成人DM患者におけるTIF1-γ自己抗体の出現を説明できる Arthritis Rheum 2012;64:346–9.
-
腫瘍抗原の除去のみに関しては、変化したTIF1-γを持たない腫瘍細胞は、T cell-dependent immuno-editing processT細胞依存的な免疫編集プロセスによって選択されている可能性がある Nature 2012;482:400–4.
-
異常なTIF1-γを発現している腫瘍細胞に対しては自己抗原に対するトレランスが失われ、抗腫瘍反応で抗TIF1-γ抗体が産出される
-
産出された抗TIF1-γ抗体は筋肉や皮膚細胞中のwild-typeのTIF1-γと交差反応を起こす
-
筋肉や皮膚細胞を非特異的に損傷する
-
再生中の筋肉細胞は、TIF1-γを含む筋炎の自己抗原を高レベルに発現している Arthritis Rheumatol 2015;67:266–72.
-
ゆえに、大量に発現したTIF1-γ抗原に対して、抗TIF1-γ抗体による交差反応がおこることで、自己免疫を介した皮膚や筋肉の炎症を誘発している可能性がある
-
実際に、TIF1-γ 陽性DM患者ではwild-typeのTIF1-γの発現増加している Clin Exp Dermatol 2017;42:659–62.
-
TIF1-γの発現が変化している癌のすべてが筋炎を引き起こすわけではない
-
筋炎は特定のHLA配列(白人ではHLA-DRB1*0301およびHLA-DQA1*0501)と関連している
-
特に抗TIF1-γ自己抗体はHLA-DQA1*0301と関連している Arthritis Rheum 2006;54:3682–9.
-
抗 TIF1-γ 抗体患者において、HLA-アレルグループ DQB1*02 との強い HLA 関連性が観察されている
-
興味深いことに、HLA-DQB1 locus遺伝子座における関連は成人発症患者と若年発症患者で異なっている
-
(成人ではHLA-DQB1*02:02、若年ではHLA-DQB1*02:01)
-
最も強い関連はHLA-DRB1*03:01であり、それはHLA-DQB1*02:01と同じhaplotypeハプロタイプ(半数体の遺伝子型)上であった
-
その他の仮説としては、自己免疫が癌を引き起こすというものがある Front Immunol 2017;8:992.
-
TIF1-γを標的とする自己抗体は、上皮間葉転換、β-カテニン、有糸分裂との相互作用を通じて、TIF1-γの腫瘍抑制機能を理論上無効にする可能性があるがあるが、こんも仮説に対する論文はほとんどない。
Detection of TIF1-γ autoantibodies and cancer risk TIF1-γ自己抗体の検出とがんリスク
-
抗TIF1-γ自己抗体は、若年性DM患者の22~32%および成人DM患者の7~31%で確認される Curr Opin Rheumatol 2016;28:636–44.
-
上記で述べたように、抗TIF1-γ自己抗体は若年性DMではかなり頻繁に認められる。
-
しかしながら癌との関連は成人DMに限定されているため、異なる細胞プロセス、免疫反応性、遺伝的素因を持つ異なる病態生理を示唆されている Acta Reumatol Port 2013;38:234–41.
-
ゆえに、したがって、抗TIF1-γを使用してがん関連DMを予測することは、成人においてのみ有用
-
特にIgG2サブタイプの抗TIF1-γ自己抗体が死亡率と関連していた Arthritis Rheumatol 2019;71:1360–70.
-
他のMSAのうち、抗NXP2だけが、同様に悪性腫瘍と明確に関連している
-
一般に癌関連DMの臨床的なリスクファクターには、高齢、男性、嚥下障害、皮膚壊死が含まれる Br J Dermatol 2013;169:838–47.
-
皮膚所見としては、抗TIF1陽性DM患者は、palmar hyperkeratotic papules掌蹠角化性丘疹, psoriasis-like lesions乾癬様病変 and hypopigmented色素欠乏症 and telangiectatic patches毛細血管拡張性斑といった特有の皮膚表現型を有する J Am Acad Dermatol 2015; 72:449–55.
-
これらの皮膚症状自体は、DM患者の癌との関連は示されていないが、抗TIF1-γ自己抗体の可能性を疑う
-
成人では、抗TIF1-γ自己抗体の検出と悪性腫瘍の診断の間には時間的な関連がある Rheumatology (Oxford) 2019;58:650–5.
-
英国で行われた大規模コホート研究のデータでは、抗TIF1-γ自己抗体を持つ患者の癌は、筋炎の診断前3年以内または診断後2.5年以内に専ら診断されたことが明らかにされている。
-
さらに、年齢が39歳以上で抗TIF1-γ自己抗体を持つ患者は、39歳未満の患者と比較して、がんを発症するリスクが有意に高い Rheumatology (Oxford) 2019;58:650–5.
-
DMは多くの種類のがんと関連する可能性があるが、卵巣がん、肺がん、大腸がん、膵臓がん、非ホジキンリンパ腫が最も頻度が高い Lancet 2001;357:96–100.
-
抗TIF1-γ自己抗体の検出に関しては感度や特異度が異なる
-
immunoprecipitation免疫沈降法は、癌関連DMに対する全体的な特異度が89%、感度が78% Arthritis Rheum 2012;64:523–32.
-
免疫沈降法最も好ましい方法であるが、時間と費用がかかるので、ルーチン検査には好まれなく、ELISA and dot or line immunoassaysなどの新しい臨床検査法の利用が進んでいるが、性能に大きな差もある
-
単施設コホート研究では、抗 TIF1-γ 自己抗体の検出において免疫沈降法と line immunoassaysとの間では、moderate agreementのみであった Ann Rheum Dis 2019;78:858–60.
-
単施設コホート研究では、抗 TIF1-γ 自己抗体の検出においてdot と line immunoassays間ではメーカー間の反応性の違いは抗TIF1-γで最も顕著であり、有病率は2.1~12.4%の範囲 Ann Rheum Dis 2019;78:e7.
-
皮膚の表現型 と抗核抗体のパターン(speckled)の一致は、抗TIF1-γ自己抗体の存在を示唆する可能性がある JAMA Dermatol 2016;152:1049–51.
-
高齢者における抗 TIF1-γ と癌関連 DM との強い関連性を考えると、癌は IIM の主な予後因子である
-
ゆえに、がん関連DMを予測するマーカーとして抗TIF1-γ自己抗体を用いることは、成人において非常に有用である Ann Rheum Dis 2006;65:1456–61.
-
抗 TIF1-γ 抗体保有者においては、がんに対するより厳しいメンテナンスが必要であり、少なくとも診断後 3-5 年は年 1 回の PET/CT 検査は適切だろう Curr Opin Rheumatol 2010;22:627–32. Curr Opin Rheumatol 2010;22:627–32.





