
Acute exacerbation of interstitial lung disease associated with rheumatic disease. Nat Rev Rheumatol. 2021 Dec 7.
【結論】
-
acute exacerbation in rheumatic disease–interstitial lung disease (AE-RD-ILD)は、発症時または発症直後の死亡率が高く、1年生存率が極めて低い
-
現在の AE-IPF の定義では、特発性急性増悪と誘因性急性増悪の両方が考慮されるが、誘因性 AE-RD-ILD が特発性 AE-RD-ILD より予後が悪いかどうかははっきりしない。
-
急性増悪に伴う臨床症状は、リウマチ性疾患とIPFで類似しているが、AE-RD-ILD は AE-IPF に比べ発症頻度が低く、死亡率も低いと考えられている
-
AE-RD-ILDに関する知識は、特に病因、病態、管理に関してはまだ研究は十分でない
-
AE-RD-ILDの兆候は早期に発見されなければならず、AE-ILDの発症リスクが高い患者さんは、症状やHRCTの特徴が現れる前に、素因のある患者を特定できるバイオマーカーが必要であり、さらなる研究が必要である
【Key point】
-
リウマチ性疾患患者において、interstitial lung disease (ILD) 間質性肺疾患は罹患率および死亡率の主要な原因である
-
リウマチ性疾患患者の中にはILDの急性増悪(AE-ILD)を経験するが、短期死亡率が高く、1年生存率が非常に低い
-
AE-ILDの診断は、臨床的な疑い、症状の悪化、潜在的なトリガーの特定、画像診断、他の疾患の除外によって行う
-
AE-ILDの管理戦略は、全身性ステロイドや広域抗生物質など、特発性肺線維症に対する推奨事項に基づいている
-
急性増悪の管理に関する無作為化比較試験は不足している
【背景】
-
ILDは炎症過程に続いて de novo fibrosis デノボ線維化や excessive accumulation of connective-tissue matrix in the lung interstitium 肺間質における結合組織マトリックスの過剰な蓄積 によっておこる肺疾患である
-
多くの場合、ILD は最終的に不可逆的な肺線維症に至り 、リウマチ性疾患患者の罹患率および死亡率の重要な原因となっている
-
現在、rheumatic disease-associated ILDs (RD–ILDs)の分類は確立されておらず、idiopathic interstitial pneumonias(IIPs)特発性間質性肺炎 の放射線学的分類や病理組織学的分類に準じた分類を用いている
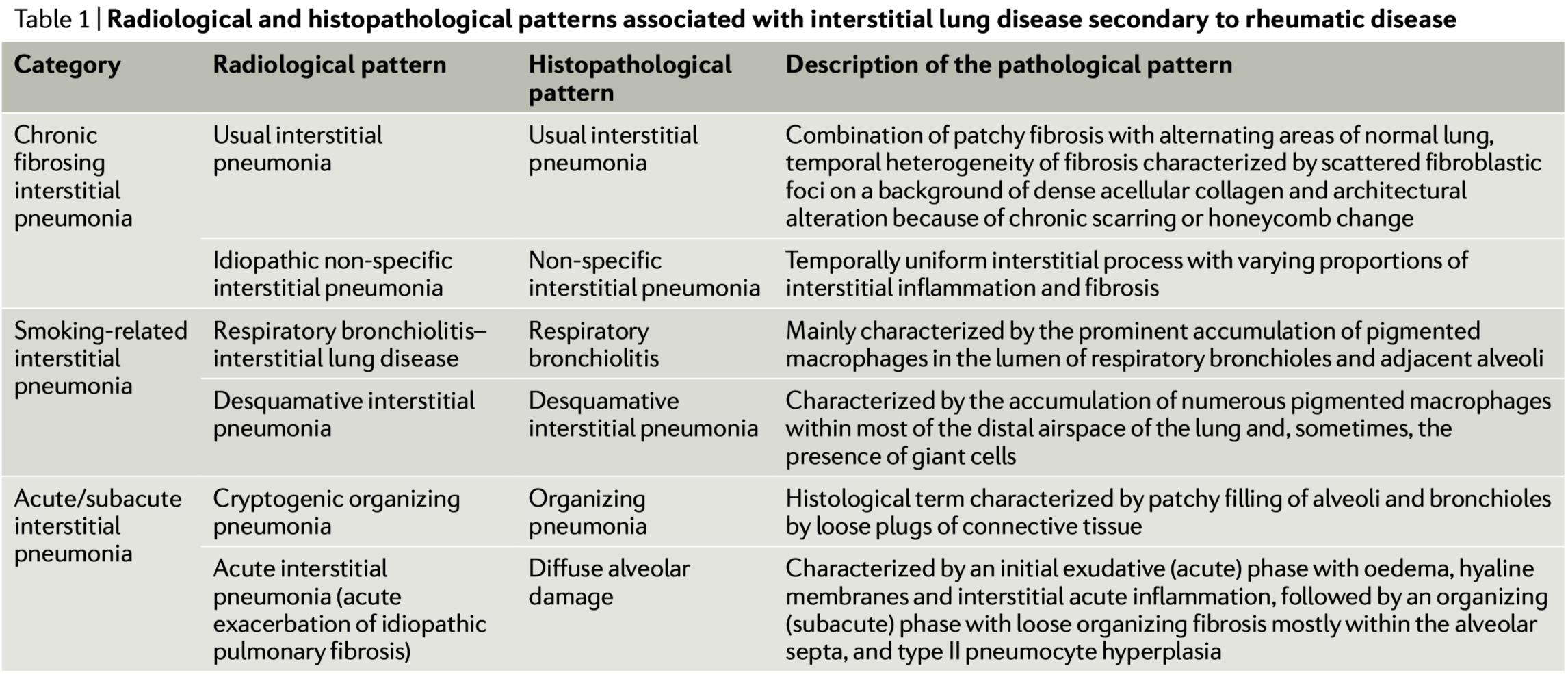
本文のTable 1 はRA-ILDパターンの表であるが、ILD分類で下図の赤枠と同等である。
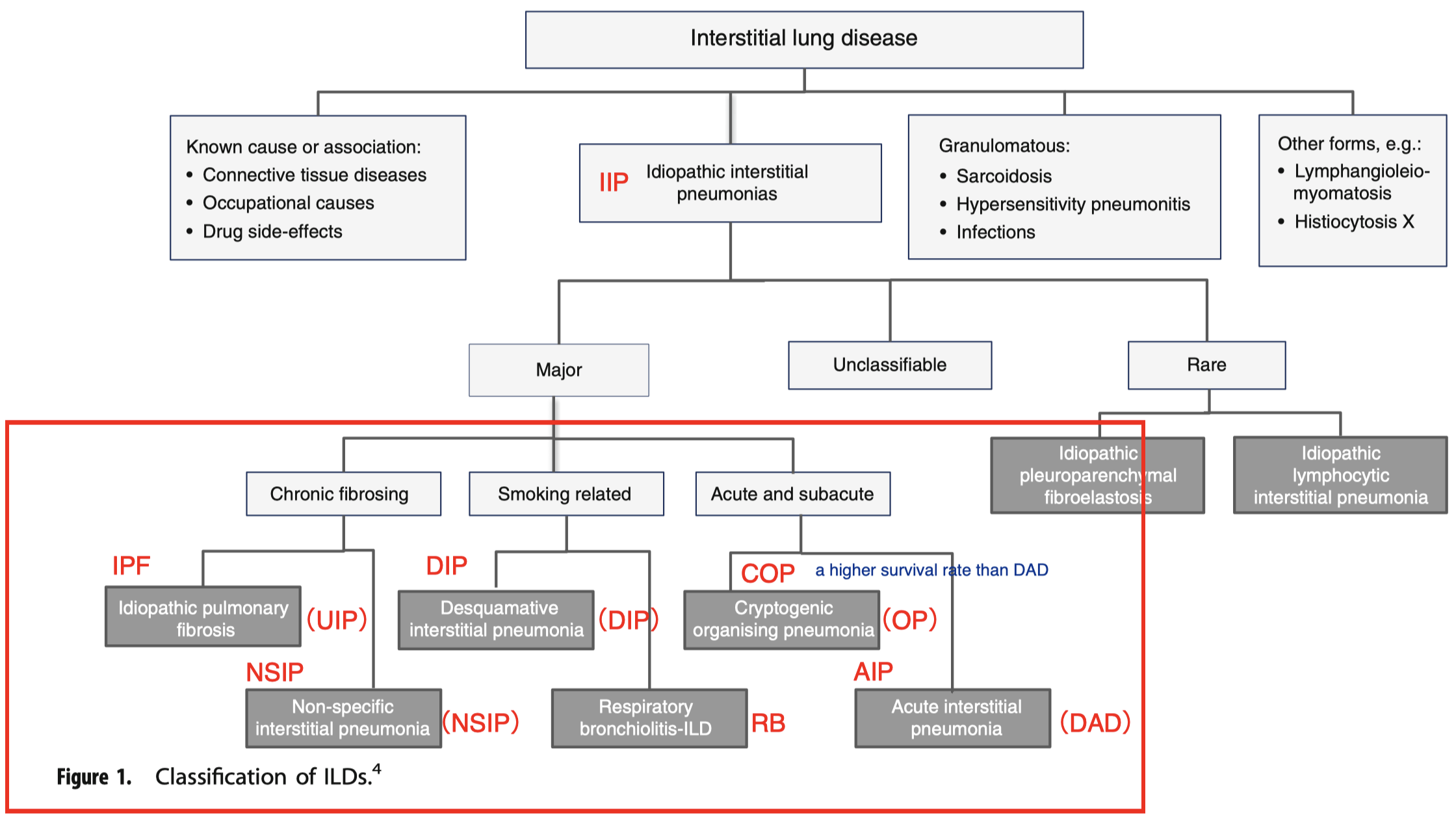
Interstitial lung disease: raising the index of suspicion in primary care. NPJ Prim Care Respir Med . 2014 Sep 11;24:14054.
-
IIPで最も多いパターンはusual interstitial pneumonia (UIP)パターンであり、臨床的にはidiopathic pulmonary fibrosis (IPF) 特発性肺線維症に相当する
-
IPFと同様に生存率の低い関節リウマチ(RA)関連ILD(RA-ILD)においても、UIPが最も一般的なパターンであるとする研究もある
-
connective-tissue disease (CTD)結合組織病と UIP パターンを有する患者は、IIP と UIP を有する患者よりも予後が良好よい
-
Non-specific interstitial pneumonia (NSIP)非特異的間質性肺炎は、ILD およびsystemic sclerosis (SSc)全身性強皮症、idiopathic inflammatory myopathies (including antisynthetase syndrome) 特発性炎症性筋疾患、primary Sjögren syndrome原発性シェーグレン症候群に最も多く見られる IIP パターンであり、一般にこれらの患者は IPF や UIP を伴う RA-ILD 患者よりも良好な予後を示す
-
急性増悪は、ほぼすべてのタイプの ILD で発生し、生存率の低下と関連する。
-
RD-ILD の急性増悪に伴う組織学的パターン(AE-RD-ILD)には、diffuse alveolar damage (DAD)びまん性肺胞損傷がよく見られ、これはacute respiratory distress syndrome(ARDS)急性呼吸窮迫症候群に見られるものと同様
-
ARDSとAE-RD-ILDの違いは ILDを背景にもつかどうかである
Reviewの目的
-
AE-RD-ILD の定義,疫学,主要な発症機序のサマリー
-
関連する臨床的特徴,診断基準,予後評価,モニタリング,マネジメントについて考察
【AE-RD-ILD の定義】
- 現在、IPF 以外の ILDs における急性増悪には、現在のところ個別の具体的な定義がない
- 今回、AE-IPF の定義に関する 2007 年と 2016 年の基準を考慮し,RD-ILD の特徴に基づいて AE-RDILD の同等の定義(表Table 2)を著者らは提案した
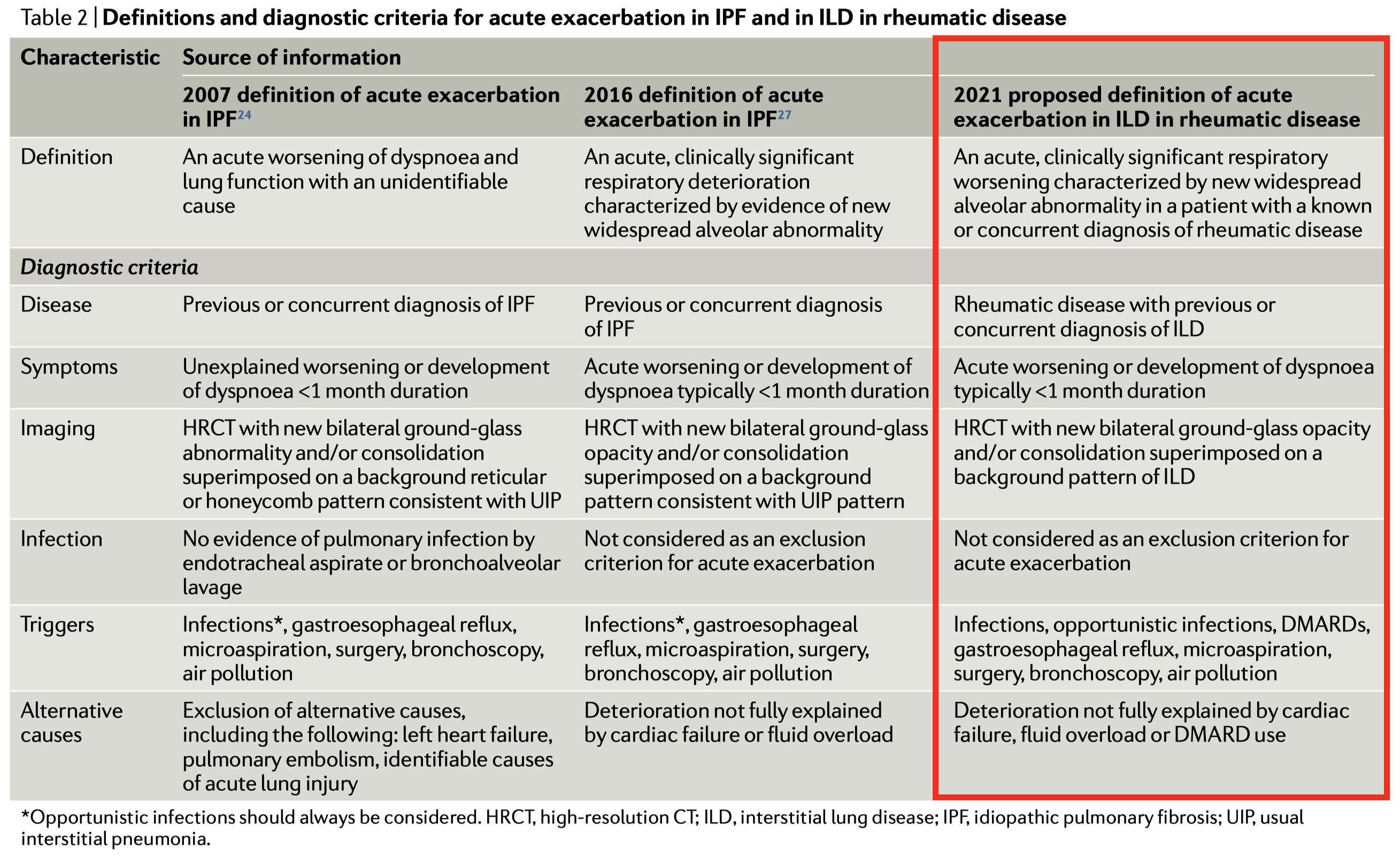
定義:
急性かつ臨床的に有意な呼吸器疾患の増悪であり、新たに広範囲の肺胞異常を特徴とする、既知または新規にリウマチ性疾患と診断されている患者
症状:
急激な呼吸困難の悪化または発症(典型的には1ヶ月以内)
画像:
ILDに重なる、両側性のすりガラス陰影 and/or 浸潤影がHRCTで認めること。
感染:
急性増悪の除外基準としては考えない
トリガー:
Infections, opportunistic infections日和見感染症, DMARDs, gastroesophageal reflux胃食道逆流症, microaspirationマイクロアスピレーション, surgery, bronchoscopy気管支鏡, air pollution大気汚染
その他の要因:
心不全や体液過剰、DMARDs服用では十分に説明できない症状の悪化
【Epidemiology 疫学】
-
ILDの有病率は、全身性エリテマトーデスの4〜13%、SScの65〜91%、RA-ILD の有病率は米国では最近10 万人あたり 3.2 人から 6.0 人に増加
-
IPF 患者における AE-IPF の年間発生率は 1~20%
-
1 年間の AE-RDILD 発生率は 1.25%~7.2%
-
UIP パターンを示す RA-ILD 患者の 11.1%と比較して、UIPパターンのAE-RD-ILD の発症率は 5.6%
-
UIP の有病率は RA-ILD > CTD-ILD であるためため、RA-ILD における急性増悪の頻度が高いことは、UIP パターンそれ自体が AE-ILD の高リスクと関連しているかもしれない
-
diffuse SSc と anti-topoisomerase I antibodies抗トポイソメラーゼ I 抗体陽性患者はLD(AE-RD-ILD を含む)の発症率が高く、SSc 関連の死亡につながりやすい
-
SSc 患者 139 名のレトロスペクティブ研究では、47.5%が ILD を併発している。
-
そのうちAE-ILD を発症した 9.4% では、AE-ILD のない患者よりも多発性筋炎や皮膚筋炎の合併率が高く、また死亡率が高い。だが 抗セントロメア抗体の陽性率は低い
-
-
顕微鏡的多発血管炎と ILD を有する患者では,1 年間の急性増悪の累積発生率は 7.2%と推定されている
-
上記をまとめるとUIP パターン,RA-ILD または SSc-ILD の診断,多発性筋炎や皮膚筋炎との重複が AE-RD-ILD の危険因子である
【Pathophysiology 病態生理】
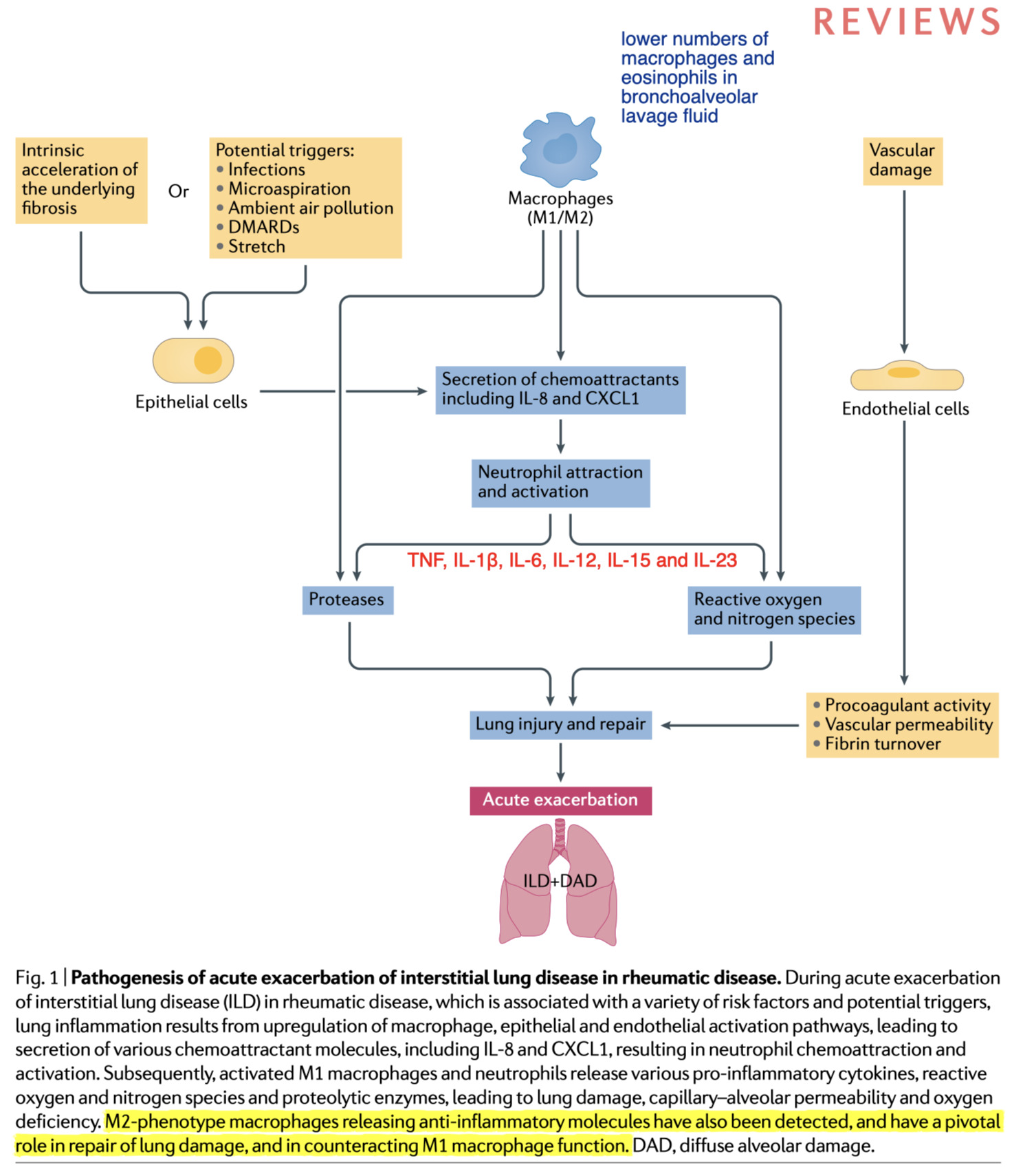
-
ARDS と同様に、AE-ILD は非 AE-ILD に比べて気管支肺胞洗浄液中の好中球数が多く、マクロファージや好酸球数が少ない。注目すべきは、肺有害②肺毒性物質への曝露に対する反応として、IL-8 や CXCL1 などのケモカインの産生と、組織損傷部位での炎症性(M1 とも呼ばれる)マクロファージの集積が見られる
-
活性化されたM1マクロファージは、TNF、IL-1β、IL-6、IL-12、IL-15、IL-23などの様々な炎症性サイトカインを放出する
-
そしてReactive oxygen細胞障害性の活性酸素・nitrogen species窒素種、Proteasesタンパク質分解酵素、生理活性脂質を生成する
-
また、T helper 2 型サイトカイン(IL-4、IL-13)に反応して抗炎症分子(IL-10、TGFβなど)を放出し、炎症性メディエーターを抑制するM2マクロファージが産生されていおり、肺の損傷の修復に極めて重要な役割を担っている
-
他にもAE-ILD を発症した患者の肺では,Vascular permeability血管透過性が上昇して、線維性肺疾患患者では、Vascular permeability血管透過性、Procoagulant activity血液凝固促進活性、Fibrin turnoverフィブリンのターンオーバーを促進して、これらは肺のコンプライアンスの低下と相関している
-
肺胞内フィブリン蓄積は肺損傷の特徴であり、DAD 患者の疾患の重症度や転帰と相関している
-
AE-RD-ILD の病態生理が他の ILD 型の急性増悪と類似しているかはまだ不明である。
-
DAD は AE-IPF の結果死亡した人の剖検で認めているが、他にもRD-ILD など他の ILD の人の剖検でも検出される
-
organizing pneumonia(OP)パターンの場合はDADパターンよりも生存率が高い。ステロイドおよび免疫抑制治療への反応性がよいことを示唆している。
Triggerについ
■肺感染症
- 感染症の役割を示す証拠として、AE-IPF の季節性(ほとんどの症例が冬季に発生する)や 気道感染症が急性増悪と同様の死亡リスクを与えるという観察結果がある
- 感染症が確認された場合の死後検査では、AE-IPF と同様の DAD がしばしば認められ,プラセボと比較して免疫抑制剤投与は感染症の発生率や急性増悪の発生率と関連している
■Microaspiration
- AE-IPF 患者の気管支肺胞洗浄液駅BALFにおいて安定した IPF 患者のBALFよりも高い濃度のペプシン(胃内容物吸引のマーカー)が検出されたことから、すべての ILDs において急性増悪の発症と関係がある可能性がある
- IPF 患者を対象とした 3 つの臨床試験の事後分析では,急性増悪を起こした患者のうち,抗酸剤治療を受けてい た患者はいなかった
- SSc に伴う ILD 患者のコホートでは、refluxは肺機能の低下と関連していた
- refluxとAE-SSc-ILD の関係はまだ証明されていないが、胃食道逆流症は SSc 患者の 70%以上が罹患していることから、AE-RD-ILD にはMicroaspirationの関与が示唆されている
■exposure to ambient air pollution 大気汚染への暴露
- 患者の大規模なコホートに関するレトロスペクティブ研究では,オゾンと二酸化窒素への 平均および最大暴露が AE-IPF のリスクと関連
- 大気質基準値を超える汚染物質への曝露頻度も AE-IPF のリスクと関連
■Mechanical stress 機械的ストレス
-
手術は急性増悪の原因となることがあり、これはおそらく肺への機械的ストレスの結果である
-
肺の手術後の AE-ILD の発生頻度は、肺以外の手術後と同程度である
-
prolonged mechanical ventilation長時間人工呼吸, high tidal volume、high intraoperative concentration of supplemental oxygen 術中高濃度酸素の関与がありそう。
-
-
肺機能が低下している患者が複数回のBALを受けると、1回のBALを受ける場合よりも AE-ILD のリスクが高くなる可能性がある
■DMARDs
- conventional synthetic DMARDであるmethotrexateメトトレキサートによる肺炎自体は、通常メトトレキサート開始後すぐに発症し、その発症は用量に依存しない
- RA患者の肺疾患におけるメトトレキサートの役割に関するnarrative reviewでは、メトトレキサート関連の肺炎はRA-ILDの発症と関連しない
- メトトレキサート使用そのものと AE-RA-ILD の発生は関連しないことも示されている
- メトトレキサート代替薬であるレフルノミドが RA-ILD の発症・悪化と関連している
- biologic DMARDsやtargeted synthetic DMARDsはは、RA 患者の ILD の新規発症または既存 ILD の増悪の原因となりうる
【臨床所見】
- 急性増悪がリウマチ性疾患の初発症状である場合、リウマチ性疾患の肺外症状がなければ、 AE-RD-ILD と IIP による急性増悪の鑑別診断は非常に困難
- RA-ILD 患者の約 10%、皮膚筋炎、antisynthetase syndrome抗ARS抗体症候群、SSc などの他のリウマチ性疾患では、全身症状が臨床歴の後半に現れるか、軽度のままか、過小評価されることがある。
- 抗ARS抗体症候群では抗 PL-7 抗体および抗 PL-12 抗体の存在が陽性であっても、 ILD が唯一の臨床症状として認められる場合がある
- microscopic polyangiitis顕微鏡的多発血管炎などのantineutrophil cytoplasmic antibody (ANCA)–associated vasculitides,は、ILD を併発し、急性増悪を示すことがある
- 特にRA-ILDはIPFと多くの類似性があり特に、UIPパターンを有するILDが関節病変に先行する場合、RA-ILDとIPFの鑑別診断が困難となる場合がある
- ACPA の検出は RA に非常に特異的であり、RA 患者において、ILD や急性増悪のリスクは、高力価の ACPA の存在や持続的な関節活性化疾患と正の相関があることが示されている
- DMARDs の AE-RA-ILD の誘因としての役割については議論中であり、急性増悪における DMARDs は、リウマチ性疾患、RD-ILD および AE-RD-ILD の病態にサイトカイン(特に TNF)が関与している可能性がある
【画像所見 】
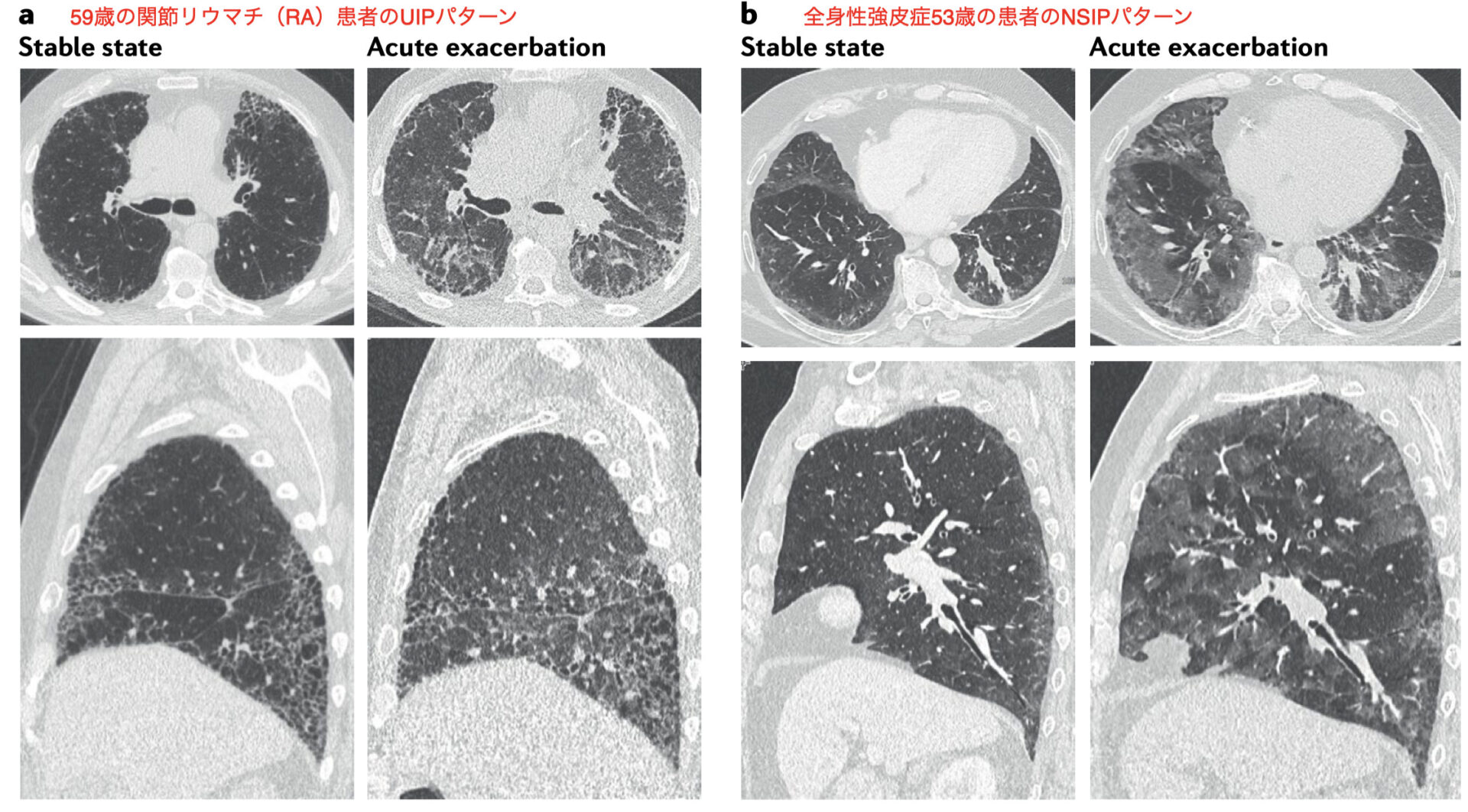
a: 安定している典型的なUIPパターン(左から1枚目)
-
肺区域全体にpropeller-bladeプロペラ翼状分布でsubpleural reticulation layered層状化した胸膜下網状影
-
traction bronchiolectasis–bronchiectasis牽引性気管支拡張症
-
volume loss容量減少を伴う
b: 急性増悪(左から2枚目)
-
ground-glass opacities with extensive patchy distribution広範なパッチ状の分布をもつスリガラス影
-
increase in subpleural reticulation and of severity in traction bronchiectasis胸膜下網状の増加および牽引性気管支拡張症の重症化
-
further signs of distortion with volume loss 容量減少の増悪
c: 安定しているNSIPパターン(左から3枚目)
-
ground-glass opacities with homogeneous distribution均一な分布のスリガラス影
-
sparing of subpleural parenchyma 胸膜下実質はsparingされている
b: 急性増悪(左から4枚目)
-
increased extent of ground-glass opacities with diffuse involvement of all the lung parenchymaすべての肺実質にびまん性に浸潤したスリガラス影
-
with some areas of patchy sparing, without apparent signs of substantial volume loss. いくつかの領域はパッチ状に温存されており、実質的な容積損失は伴っていない(斑状影)
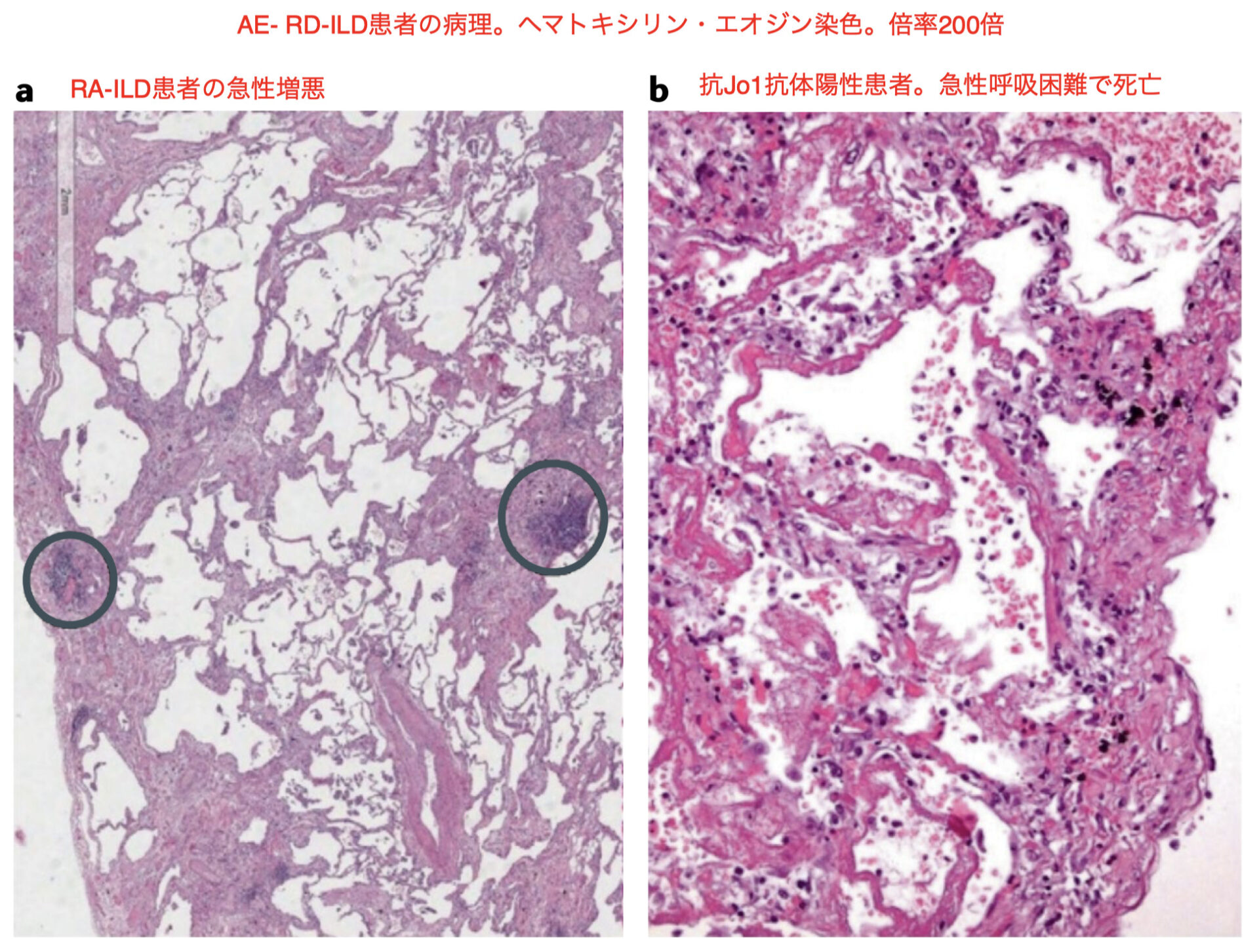
【病理所見】
a: 実質と胸膜の組織
-
heterogeneous spatial and temporal fibrosis, occasional fibroblastic foci 不均一な空間および時間の線維化があり、線維芽細胞のfociが見られる。
-
lymphoid follicular hyperplasia (circles) involving both parenchyma and pleura 線維芽細胞巣およびリンパ濾胞過形成(○)
b: DADパターンの特徴を示している。
-
endoalveolar hyaline membranes肺胞内ヒアリン膜やfibrin and debrisフィブリンおよび破片、
-
lymphocytes and polymorphonuclearcell infiltratesリンパ球および多形核細胞の浸潤を示す
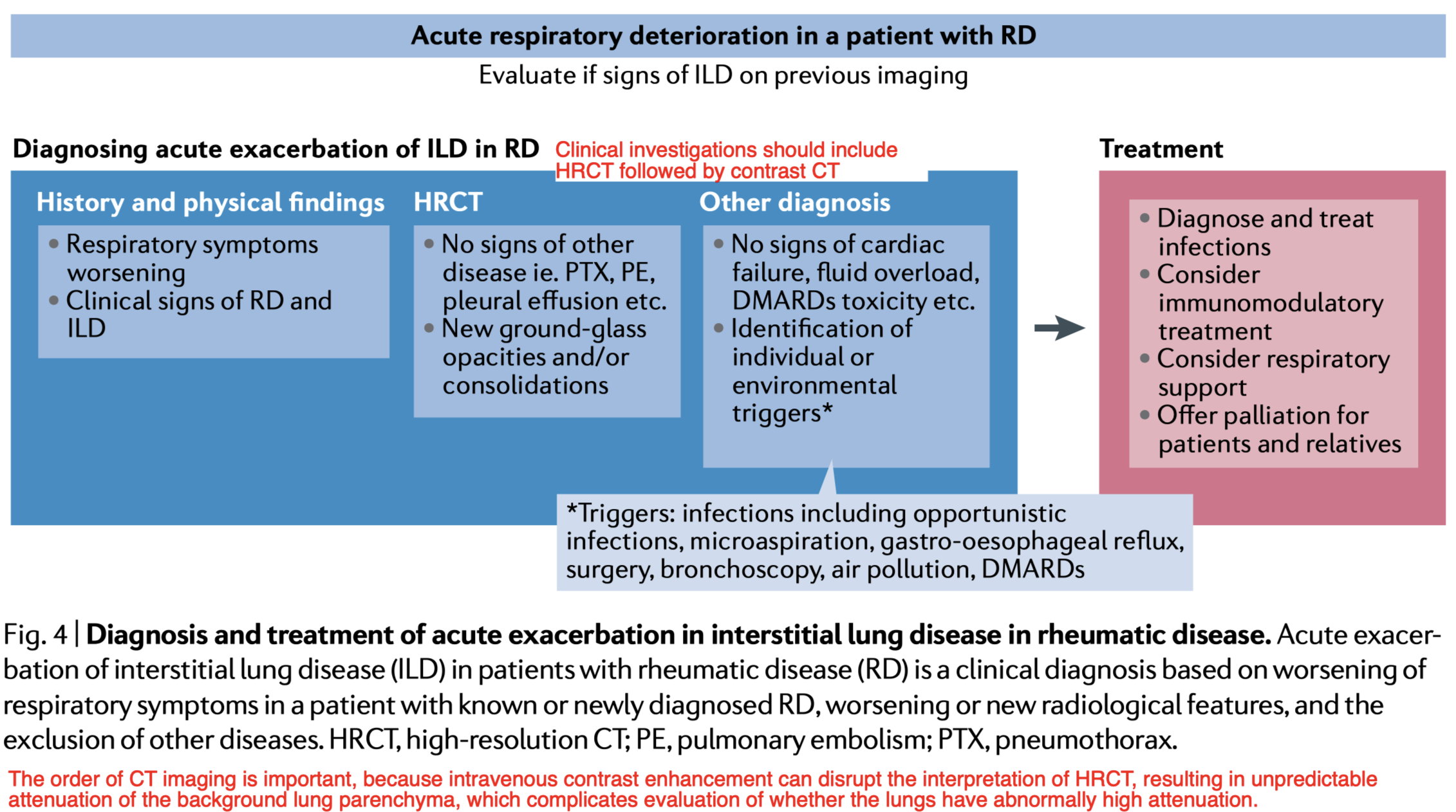
【Diagnosis 診断】
-
上記で示したTriggersを除外する。
-
肺塞栓症の確認または除外のために、HRCTに続いて造影CT(必要な場合)を行う必要がある。
-
心不全や体液過多、肺塞栓症などの競合疾患の診断は除外する必要がある
-
CT撮影の順番は重要であり静脈内造影はHRCTの解釈を乱し、背景の肺実質の減衰を予測できないため、肺の減衰が異常に大きいかどうかの評価が複雑になる。
-
RA-ILD の研究では,RA-ILD 診断時の KL-6 濃度の変化が急性増悪と関連しており、,ILD の血中バイオマーカーである KL-6 は AE-RD-ILD の予後マーカーとしての可能性が示唆された
-
AE-RD-ILD の診断には、血液、尿、喀痰を採取し培養する必要があるが、気管支鏡検査による微生物学的検査には異論がある。
-
AE-IPF 患者では、気管支肺胞洗浄液に好中球増加 が認められ、まれにリンパ球増加が認められる
-
ILD 患者で急性呼吸器悪化を認めた 225 例を対象とした研究で、106 例(RD-ILD 37 例)が肺胞出血または感染を除くために気管支鏡検査を受け、16 例(13%)が気管支鏡検査陽性となったが、この所見により初期管理を変更したのは 4 例(3%)であった
-
気管支鏡検査の結果,新たに集中治療室や人工呼吸器での治療が必要になったり,長期化したりした患者も少なくなかった
-
酸素需要の高い非挿管患者に対するBALは、低酸素血症を悪化させ、患者にとって不利益となる可能性があるため、慎重に検討し限られた AE-RD-ILD の症例にのみ実施すべき
-
【Prognosis 予後】
-
AE-RD-ILD の予後的には院内死亡率は 50-100%であり、人工呼吸補助を必要とする患者の死亡率は 90%以上であるであるが、AE-RD-ILD 後の院内死亡率は、研究によって大きく異なる。
-
ベースラインの肺機能や酸素化以外の予後因子として、ILD 診断から急性増悪発生までの期間、末梢血好中球数の高値などがある
-
急性増悪を認めなかった患者でも、肺機能障害と呼吸器症状(主に呼吸困難)の悪化のため、QOL が低下し、長期生存率が低下する
【Management 管理】
- IPF ガイドラインでは,AE-IPF 患者に全身性ステロイドを使用することを弱く推奨しており、使用方法に関するの推奨はない。
- しかし,AE-IPF 患者の治療に関するレトロスペクティブスタディの結果では,ステロイドの使 用による転帰の改善を示す証拠もない
- AE-RD-ILD 患者ではDMARDs の中止が治療戦略の最初のステップである。またTNF や IL-6 の阻害剤など RA 治療のための薬剤は、既存の ILD の進行と急性増悪の発生に関連している
- AE-RA-ILD 患者に対しては、高用量ステロイド・シクロホスファミド・リツキシマブの静脈内投与が提案されているが、これらの戦略を支持する証拠は限られている
- AE-RD-ILD とリウマチ性疾患の経過中に発症する気管支肺感染症は鑑別が困難であり,両疾患は重複する可能性があるため,AE-RD-ILD およびリウマチ性疾患の経過中に発症する気管支肺感染症の急性増悪時には,広域抗生物質の投与がしばしば行われている
- 2019 年の英国ガイドラインでは、ILD は TNF 阻害薬の絶対禁忌とはされていないが、生物学的 DMARDs で治療を受けている RA-ILD 患者には厳重な監視が示唆されている
- メトトレキサートに関しても議論があり、RA-ILD の臨床的特徴、AE-ILD の危険因子、死亡率を調査した結果、メトトレキサートは AE-RA-ILD に対して保護効果があることが示唆された
- 2021 年,ACR は RA-ILD 患者に対し,メトトレキサートの有効性と長期的な安全性プロファイルを持つ代替薬剤がないことを理由に,条件付きで使用を推奨している。既存の肺疾患を持つ患者には、この治療を開始する前にメトトレキサート肺炎のリスクについて説明する必要がある
- AE-IPF 患者の多くは急性呼吸不全を発症するが,現在の治療ガイドラインでは,人工呼吸の有効性が低いことから,これらの患者には人工呼吸を行うべきではない
- AE-RD-ILD を含む AE-ILD 患者の大多数は集中治療室内または経過観察中に死亡するため 、特に感染や紛らわしい要因が除外された場合には、一般的に挿管を行わない。
- しかし、ごく一部の患者は集中治療室から退院することができ、肺移植が可能であれば、肺移植を検討する機会を与えることができる





